Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Actualités du secteur
Guide d'apprentissage de la photométrie à fibre pour les débutants
apprendre la technologie de la photométrie par fibre
Si vous commencez à vous familiariser avec la technologie de la photométrie à fibre, cet article devrait vous être très utile.
La photométrie par fibre est une méthode optique qui repose sur le principe de la mesure de la lumière émise par des molécules fluorescentes par le biais d'une fibre optique basée sur le comptage de photons uniques corrélés dans le temps (TCSPC). À partir de ce principe, nous savons que la réalisation de cette expérience nécessite des outils de sonde qui peuvent exprimer la fluorescence dans le tissu, ainsi qu'un ensemble d'équipements qui peuvent transmettre la fluorescence et la détecter.
Nous nous penchons donc d'abord sur les outils de fluorescence. Actuellement, les outils de fluorescence les plus couramment utilisés sont divisés en indicateurs de calcium, indicateurs de neurotransmetteurs, indicateurs de tension, etc. Comme il existe de nombreux types de modèles animaux pour les applications expérimentales, et que nous devons également étudier des régions cérébrales spécifiques ou même des types de cellules spécifiques, les techniques d'édition de gènes ont été largement utilisées pour le développement de sondes.
Les indicateurs de calcium génétiquement codés (GECI) courants sont des protéines fluorescentes dérivées de la protéine fluorescente verte (GFP, etc.) et de ses variantes (par exemple, GFP, YFP, CFP, RFP disposés circulairement, etc.) fusionnées à la calmoduline (CaM) et au domaine M13 de la kinase de la chaîne légère de la myosine. Lorsque le Ca2+ est présent, il se lie à la CaM, ce qui entraîne une interaction entre les domaines structurels M13 et CaM, déclenchant un réarrangement structurel de la cpEGFP, qui renforce le signal de fluorescence vert/rouge.
Les GECI les plus largement utilisés sont : GCaMP, Pericams, Cameleons, TN-XXL et Twitch, parmi lesquelles GCaMP6, GCaMP7 sont désormais largement utilisées dans les études d'imagerie calcique in vivo en raison de leur sensibilité supérieure. Voici un résumé des types de GECI les plus courants.
Figure 1
GCaMP6 GCaMP6s Haute sensibilité, convient aux signaux de basse fréquence
GCaMP6m Activité modérée, large gamme d'applications
GCaMP6f Dissociation rapide, convient aux signaux à haute fréquence
jGCaMP7 jGCaMP7s Très sensible et plus rapide que GCaMP6s
jGCaMP7f Réponse Df/F améliorée, convient aux expériences de potentiel d'action unique ou d'activité de groupe
jGCaMP7b Haute luminosité du potentiel de repos, convient pour la névrite ou les fibres nerveuses
jGCaMP7c Contraste élevé, convient à l'imagerie à large spectre
jRGECO1a jRGECO1a La longueur d'onde d'excitation est décalée vers le rouge et peut être utilisée avec GCaMP
jRCaMP1 jRCaMP1a
jRCaMP1b
Axon-GCaMP Axon-GCaMP Marquer l'axone
Le principe des sondes de neurotransmetteurs est similaire à celui décrit ci-dessus : la cpEGFP est intégrée dans des récepteurs de neurotransmetteurs spécifiques, et la liaison des récepteurs aux neurotransmetteurs déclenche un changement de conformation des récepteurs en un signal fluorescent, et les changements en temps réel de la concentration des neurotransmetteurs peuvent être observés à l'aide de techniques d'imagerie. Les sondes de neurotransmetteurs qui ont été développées comprennent la DA (dopamine), l'Ach (acétylcholine), la NE (norépinéphrine), la 5HT (5-Hydroxytryptamine), l'Ado (adénosine), l'ATP (adénosine triphosphate), la CCK (cholécystokinine), le VIP (peptide intestinal vasoactif) et l'eCB (endocannabinoïde), etc.
En raison du cycle de changement de signal relativement lent des signaux calciques ainsi que des neurotransmetteurs, si nous voulons enregistrer le signal rapide du potentiel membranaire, nous devons utiliser des outils pertinents tels que les indicateurs de tension génétiquement codés (GEVI). Les variations du potentiel membranaire sont un signe direct des potentiels synaptiques et d'action. Dans certains cas, le signal GEVI est plus rapide et plus informatif que les mesures utilisant le GECI.
Après avoir compris ces indicateurs fluorescents, il faut savoir comment les exprimer chez l'animal. Cette sonde génétiquement codée peut être exprimée dans des cellules ou dans le cerveau de la souris par injection virale, transfection, croisement d'animaux et autres moyens techniques. Prenons l'exemple de l'étude de l'injection stéréotaxique dans le cerveau : 1. choisir l'outil viral approprié (contenant l'information codée par l'indicateur) à injecter dans un endroit spécifique ; 2. implanter une fibre optique pour transmettre la lumière d'excitation et recueillir la lumière d'émission ; 3. attendre 2 à 3 semaines pour que le virus soit exprimé, puis tester le signal de fluorescence.
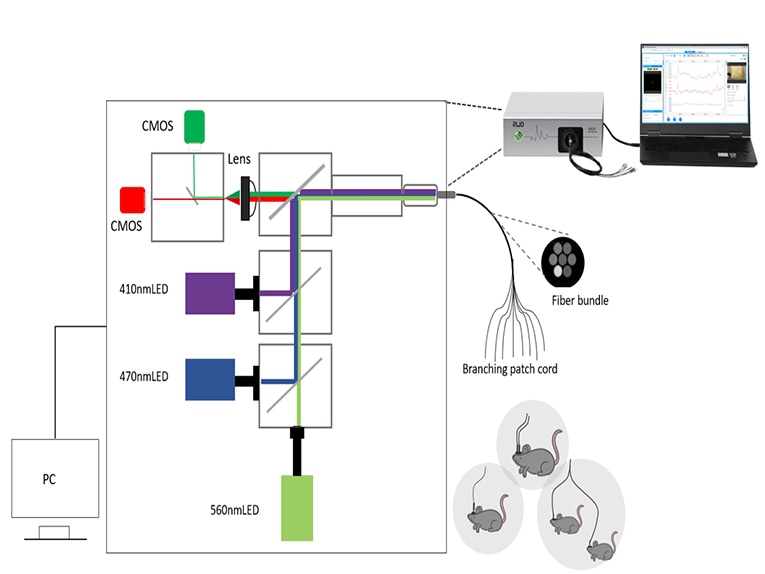
Une fois les animaux préparés, il est maintenant nécessaire de sélectionner un système approprié pour collecter et analyser le signal de fluorescence. Les composants de base d'un système de photométrie à fibre optique comprennent des sources de lumière d'excitation, des filtres, des miroirs dichroïques, des détecteurs et des accessoires de fibre optique.
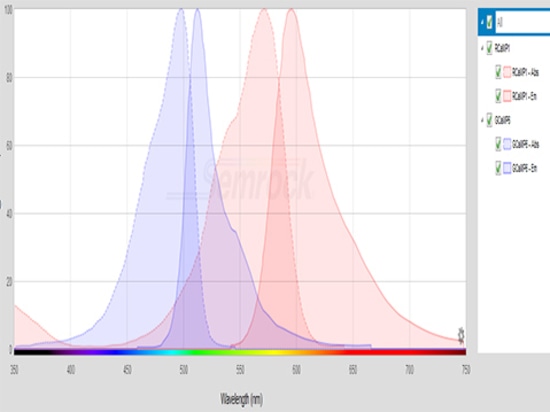
Les longueurs d'onde d'excitation du GCaMP sont concentrées entre 450nm et 500nm, tandis que celles du RCaMP sont concentrées entre 530nm et 580nm. La source de lumière d'excitation doit être choisie en fonction de la gamme de longueurs d'onde d'excitation de l'indicateur fluorescent. Il faut également choisir la puissance d'excitation appropriée, par exemple, 20μW ~ 50μW est plus approprié pour le GCaMP excité, si la puissance est trop élevée, il est facile d'entraîner un blanchiment du signal ou même une extinction.
Le filtre doit tenir compte de la plage de longueur d'onde d'émission de la protéine fluorescente. La longueur d'onde d'émission de la GCaMP est concentrée entre 500nm et 550nm, tandis que celle de la RCaMP est concentrée entre 570nm et 630nm.
Il existe de nombreux types de photodétecteurs, tels que les PMT, CCD, CMOS, photodiode, etc. On pense généralement que le PMT (tube photomultiplicateur) est très sensible et convient à la détection de signaux très faibles, mais uniquement pour les expériences à un seul canal ; le CCD peut être utilisé pour l'enregistrement multicanal, mais la vitesse d'imagerie est lente ; le CMOS est plus rentable et peut être utilisé pour l'enregistrement multicanal, tandis que la vitesse de traitement de l'image est rapide. L'enregistrement expérimental multi-canal peut utiliser une fibre optique multi-branches, à travers un système peut enregistrer plusieurs zones du cerveau ou plusieurs changements de signaux d'animaux.
Les accessoires de fibre optique doivent être sélectionnés avec une couche de protection noire et un matériau à faible autofluorescence pour mieux éviter l'interférence de la lumière ambiante et de l'autofluorescence sur le signal. Le choix des accessoires pour les expériences de photométrie par fibre optique peut être consulté dans l'article suivant Comment choisir les accessoires de photométrie par fibre optique pour une transmission du signal la plus efficace possible ? - RWD Life Science (rwdstco.com)
On peut se demander, si j'injecte deux couleurs d'indicateur fluorescent dans la même zone du cerveau, comment le détecteur fait-il la distinction entre les deux signaux différents ? Ne vous inquiétez pas, les deux signaux peuvent être acquis indépendamment en contrôlant la lumière d'excitation et le temps d'ouverture spécifique du détecteur par logiciel, ou en choisissant d'ajouter des détecteurs supplémentaires.
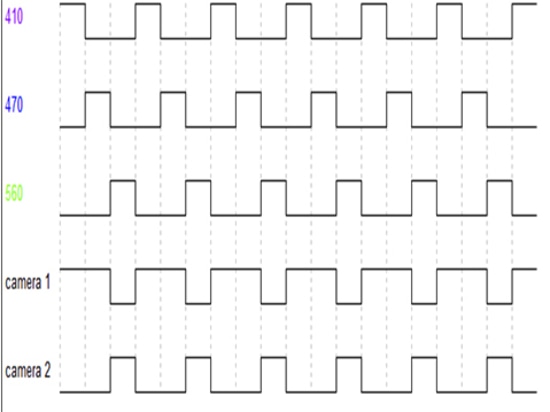
Comme on peut le voir sur la figure 5, les sources d'excitation LED 410nm, LED 470nm et LED 560nm alternent en sortie à une fréquence d'images spécifique (qui peut être définie par le logiciel). Les deux détecteurs, la caméra 1, ne synchronisent l'acquisition du signal qu'à la sortie des LED 410 et 470nm (correspondant à la collecte du signal GFP), et la caméra 2 ne synchronise l'acquisition du signal qu'à la sortie de la LED 560nm (correspondant à la collecte du signal RFP).
Dans le système de photométrie à fibre RWD, nous avons utilisé un double détecteur plus un concept d'acquisition TDM (Time-division multiplexing) (RWD R820 Tricolor Multichannel Fiber Photometry System - YouTube). Bien que la littérature ait confirmé que le TDM a été en mesure d'éviter l'interférence mutuelle de la fluorescence rouge et verte. Cependant, le détecteur unique utilise un filtre à double bande (qui peut être passé pour le vert et le rouge), et il y a une possibilité que très peu de diaphonie puisse être affectée. En effet, il existe une certaine possibilité que la LED de 470 nm excite la sonde fluorescente rouge, ce qui permet de renforcer la fluorescence rouge et de provoquer une diaphonie.
Quel est donc le rôle de la LED 410nm ? Pourquoi ai-je besoin de la LED 410 pour l'excitation simultanée lors de l'enregistrement des signaux GCaMP ? L'intensité de la fluorescence du GCaMP reste constante avec le changement de la concentration intracellulaire de Ca2+ lorsqu'il est excité par la lumière à une longueur d'onde de 405 - 420 nm. Par conséquent, on peut supposer dans une certaine mesure que la variation du signal correspondant à l'excitation à 410 nm reflète des signaux de bruit autres que la variation de la concentration en Ca2+, tels que l'autofluorescence, les changements induits par le mouvement, le photoblanchiment, etc. Lors du traitement des données, on peut cibler l'élimination du signal de fond pour obtenir le véritable signal.
Le choix d'un système approprié facilitera votre expérience. Si vous souhaitez en savoir plus sur les systèmes de photométrie à fibre, n'hésitez pas à nous contacter !