Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Tendances produits
Optogénétique et pléthysmographie du corps entier
explorer les mécanismes de contrôle du rythme respiratoire
Introduction
L'étude intitulée "Dbx1 Pre-Bötzinger Complex Interneurons Comprise the Core Inspiratory Oscillator for Breathing in Unanesthetized Adult Mice" de Nikolas C. Vann et al, publiée dans eNeuro, étudie le mécanisme par lequel les neurones pré-Bötzinger Complex (preBötC) dérivés de Dbx1 génèrent des rythmes respiratoires chez des souris adultes conscientes. En utilisant des techniques optogénétiques, les chercheurs ont manipulé avec précision l'activité des neurones pré-BötC Dbx1 exprimant l'archaerhodopsine (une protéine inhibitrice sensible à la lumière) ou la channelrhodopsine (une protéine excitatrice sensible à la lumière) et ont évalué l'impact sur le comportement respiratoire.
Contexte de la recherche
Les mouvements respiratoires des mammifères proviennent de l'activité neuronale rythmique du complexe pré-Bötzinger du tronc cérébral (preBötC). Cependant, la composition neuronale précise du pré-BötC n'est toujours pas claire. On pense que les neurones dérivés de Dbx1 jouent un rôle important dans la génération des rythmes respiratoires. Ces neurones présentent des décharges rythmiques chez les souris périnatales, mais leur rôle chez les souris adultes n'a pas été définitivement établi en raison de leur implication dans le contrôle des schémas moteurs et des fonctions non respiratoires.
Méthodes expérimentales
Animaux expérimentaux
Des souris femelles Dbx1CreERT2, exprimant la recombinase Cre sensible au tamoxifène dans les cellules progénitrices dérivées de Dbx1, ont été croisées avec des souris portant divers gènes rapporteurs. L'expression neuronale a été induite par un traitement au tamoxifène, les souris de type sauvage servant de témoins. Toutes les expériences ont été approuvées par le comité institutionnel de protection et d'utilisation des animaux et ont respecté les politiques et directives pertinentes.
Préparation des coupes de cerveau et enregistrements
Les souris néonatales Dbx1;ArchT ont été anesthésiées par hypothermie et décapitées. Des tranches de cerveau contenant le pré-BötC ont été préparées et perfusées dans une chambre d'enregistrement avec une concentration élevée en ions potassium. Les sorties motrices inspiratoires ont été enregistrées et des enregistrements de patch-clamp à cellules entières ont été utilisés pour détecter les changements dans les potentiels membranaires neuronaux.
Injection virale et implantation de fibres optiques
Des souris adultes Dbx1;ArchT et Dbx1;CatCh ont été anesthésiées et ont subi une craniotomie pour l'injection de virus et l'implantation de fibres optiques. Les souris Dbx1;CatCh ont reçu des injections de virus pour induire la recombinaison avant l'implantation de la fibre. Après récupération, les expériences ont été menées.
Mesures respiratoires
Le comportement respiratoire a été mesuré par pléthysmographie du corps entier. Les souris ont été légèrement sédatées avec du kétotifène ou brièvement anesthésiées avec de l'isoflurane à 2 %. La respiration a été évaluée en mesurant les signaux de débit d'air à travers un circuit de pression et un transducteur de pression différentielle.
Manipulation optogénétique
Les souris ont été exposées à des impulsions lumineuses de différentes intensités (6,8, 8,6 ou 10,2 mW) et durées (5 secondes ou 100 millisecondes) délivrées à des intervalles d'au moins 30 secondes. Plusieurs stimulations ont été effectuées sur chaque souris et les changements de la fréquence respiratoire, du volume courant, de la ventilation minute et des effets de réinitialisation de la phase ont été analysés.
Analyse des données
Les paramètres respiratoires ont été analysés à l'aide d'un logiciel de pléthysmographie. Des tests t par paires et d'autres méthodes statistiques ont été utilisés pour comparer les paramètres dans différentes conditions. Les courbes de réponse de phase ont été tracées en regroupant et en calculant la moyenne des effets de phase respiratoire des impulsions lumineuses.
Examen histologique
Après l'expérience, les animaux ont été perfusés et les tissus ont été fixés. Les coupes de cerveau ont été colorées avec NeuroTrace et examinées au microscope à fond clair et au microscope confocal pour vérifier l'emplacement des extrémités des fibres et ajuster le contraste de l'image.
Résultats de la recherche
Activation optogénétique (souris Dbx1;CatCh)
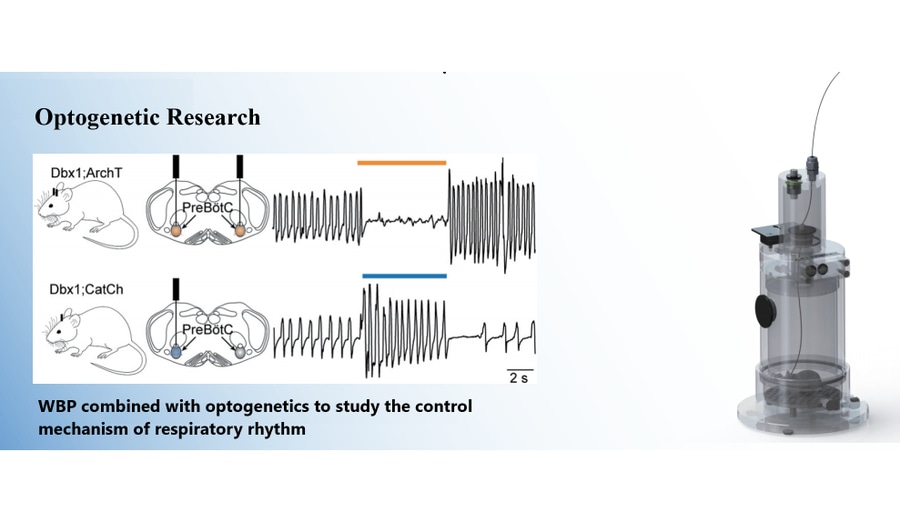
La stimulation lumineuse du pré-BötC a augmenté la fréquence respiratoire à la fois en état d'anesthésie et en état d'éveil, mais n'a pas affecté de manière significative le volume courant ou la ventilation minute. Les souris de type sauvage n'ont montré aucun changement. Une stimulation lumineuse de courte durée pendant la phase inspiratoire a prolongé le temps d'inspiration et retardé les respirations suivantes (retard de phase). Pendant la transition inspiratoire-expiratoire ou les phases expiratoires, la stimulation a fait avancer les respirations suivantes (avance de phase).
Inhibition optogénétique (souris Dbx1;ArchT)
L'inhibition lumineuse du preBötC a réduit la fréquence respiratoire, le volume courant et la ventilation minute à la fois à l'état anesthésié et à l'état éveillé, une intensité lumineuse plus élevée entraînant des effets plus importants, y compris l'arrêt respiratoire. Les compagnons de portée de type sauvage n'ont montré aucun changement. L'inhibition lumineuse de courte durée au début de l'inspiration a permis d'avancer l'inspiration suivante (avance de phase) et de raccourcir le temps d'inspiration. Au début de l'expiration, elle a retardé l'inspiration suivante (retard de phase).
Résultats électrophysiologiques
Dans les tranches de cerveau de souris néonatales Dbx1;ArchT, la lumière de 589 nm a provoqué une hyperpolarisation des neurones Dbx1 preBötC, supprimant la génération de rythmes et les sorties motrices. Les effets de l'hyperpolarisation étaient principalement post-synaptiques directs et n'affectaient que très peu les neurones non Dbx1.
Discussion
Génération de rythmes et de motifs
L'inhibition soutenue de la lumière a réduit la fréquence respiratoire et a même provoqué un arrêt respiratoire, ce qui indique que les neurones Dbx1 font partie intégrante de l'oscillateur central. La réduction du volume courant suggère leur rôle dans le contrôle du schéma moteur. La stimulation lumineuse soutenue a augmenté la fréquence de manière significative, ce qui diffère des autres études en raison des variations des conditions expérimentales.
Expériences de réinitialisation de la phase
L'activation et l'inhibition de courte durée ont toutes deux affecté la phase respiratoire et le temps d'inspiration à travers les cycles, soutenant l'idée que les neurones pré-BötC Dbx1 font partie du générateur de rythme inspiratoire.
Exclusion des effets non spécifiques
La conception expérimentale a permis d'exclure les contributions des perturbations de l'entrée préBötC, des terminaisons axonales ou des axones de passage, ce qui corrobore le rôle des neurones préBötC Dbx1 dans la génération de rythmes.
Rôle des cellules gliales
Il est peu probable que les cellules gliales influencent les résultats des expériences d'inhibition. Bien que l'expression de la CatCh dans les cellules gliales ait pu contribuer aux expériences d'activation, la comparaison des effets de l'ArchT et de la CatCh a suggéré un rôle neuronal dominant.
Taille de l'oscillateur central
Bien que la plupart des neurones Dbx1 preBötC aient des fonctions non rythmiques, un sous-ensemble forme l'oscillateur central inspiratoire. De futures études sont nécessaires pour quantifier la proportion de neurones rythmogènes non dérivés de Dbx1 et pour distinguer les neurones Dbx1 rythmogènes des neurones non rythmogènes.
Conclusion
Cette étude révèle que les neurones pré-BötC Dbx1 influencent directement la fréquence et la synchronisation respiratoires, ce qui les place au cœur de l'oscillateur inspiratoire. Ces résultats améliorent notre compréhension de la physiologie respiratoire, avec des implications pour l'étude des troubles respiratoires et le développement de cibles thérapeutiques.
Équipement utilisé dans l'étude
Système de pléthysmographie du corps entier
Utilisé pour mesurer le comportement respiratoire d'animaux se déplaçant librement. Le système détecte les changements de volume provoqués par les mouvements thoraciques et convertit les signaux de pression en signaux électriques pour l'analyse des courbes respiratoires et le calcul des paramètres (par exemple, le volume courant, le débit expiratoire maximal, la fréquence respiratoire).
Équipement optogénétique
Le laser 589 nm (Dragon Lasers) et le laser 473 nm (Dragon Lasers) ont été utilisés pour connecter les fibres optiques des souris Dbx1;ArchT et Dbx1;CatCh, respectivement, afin de permettre les opérations optogénétiques.
Système de pléthysmographie du corps entier Tow-Int Tech
Conçu pour tester la fonction respiratoire et la réactivité des voies aériennes chez des animaux conscients et non attachés. En combinant l'optogénétique avec des mesures respiratoires avancées, le système facilite la recherche sur les mécanismes de contrôle du rythme respiratoire, offrant des données précises et fiables pour l'étude des conditions physiologiques et pathologiques.
Contactez nous maintenant !
Nous nous engageons à rendre vos recherches plus faciles, plus précises et plus efficaces et à vous aider à avoir confiance en vos données ! Nous avons fourni des services à un grand nombre de clients, ce qui nous a permis d'acquérir une riche expérience dans l'offre de solutions professionnelles personnalisées en fonction de vos besoins.





