Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Actualités du secteur
Le système de surveillance du métabolisme animal Tow-Int Tech
Soutien à la recherche sur l'anorexie et l'obésité
Introduction
Récemment, des chercheurs nationaux, dont Zijun Chen, Yixiao Luo, Yingjie Zhu et d'autres, ont étudié le mécanisme d'action du liraglutide chez la souris. Ils ont découvert que les neurones positifs au récepteur GLP-1 (GLP-1R) dans le septum latéral (LS) jouent un rôle crucial dans les effets anorexiques et amaigrissants du liraglutide. Leurs conclusions ont été publiées dans The Journal of Clinical Investigation, dont le facteur d'impact est de 15,9 en 2023 et de 14,6 sur cinq ans.
1. Contexte de la recherche
L'obésité est une menace mondiale pour la santé et le liraglutide, un analogue du glucagon-like peptide-1 (GLP-1), est utilisé pour traiter l'obésité. Cependant, les sites neuronaux spécifiques de son action ne sont pas encore clairs. Les cellules exprimant le GLP-1R dans le système nerveux central sont essentielles pour les effets anorexiques et de perte de poids du liraglutide. L'hypothalamus a fait l'objet de nombreuses recherches, mais la suppression génétique du GLP-1R dans cette région n'affecte pas l'action du liraglutide. Les régions du cerveau postérieur, telles que la zone caudale, ont également fait l'objet d'un intérêt, bien que des résultats contradictoires aient été obtenus. Le septum latéral (LS) exprime également le GLP-1R et est impliqué dans la régulation énergétique, mais la fonction physiologique de ses neurones et leur rôle dans les effets du liraglutide restent à définir.
2. Objectif de la recherche
L'étude vise à révéler le rôle des GLP-1R dans le septum latéral dans les effets physiologiques et pharmacologiques du liraglutide, y compris la régulation de l'homéostasie énergétique et leur implication dans les effets anorexiques et de perte de poids induits par le liraglutide.
3. Méthodes expérimentales
Modèles animaux : Diverses souris transgéniques ont été utilisées, notamment des souris GLP-1R-ires-Cre, des souris rapporteuses Ai14, des souris Rosa26-LSL-Cas9 et des souris C57BL/6J de type sauvage.
Techniques :
Immunohistochimie : Déterminer la distribution des GLP-1R dans le cerveau de la souris.
Injection de vecteurs viraux : Y compris l'utilisation de la technologie CRISPR/Cas9 pour éliminer sélectivement l'expression du GLP-1R dans des neurones spécifiques ou surexprimer le GLP-1R.
Chimiogénétique et optogénétique : Pour activer ou inhiber les neurones positifs au GLP-1R dans le septum latéral.
Photométrie à fibres : Enregistrement de l'activité neuronale.
Électrophysiologie : Étude de la transmission synaptique dans les neurones.
Expériences comportementales : Y compris des mesures de la prise alimentaire, des évaluations du poids corporel, des tests de tolérance au glucose par voie orale et des tests d'aversion gustative conditionnée.
4. Résultats expérimentaux
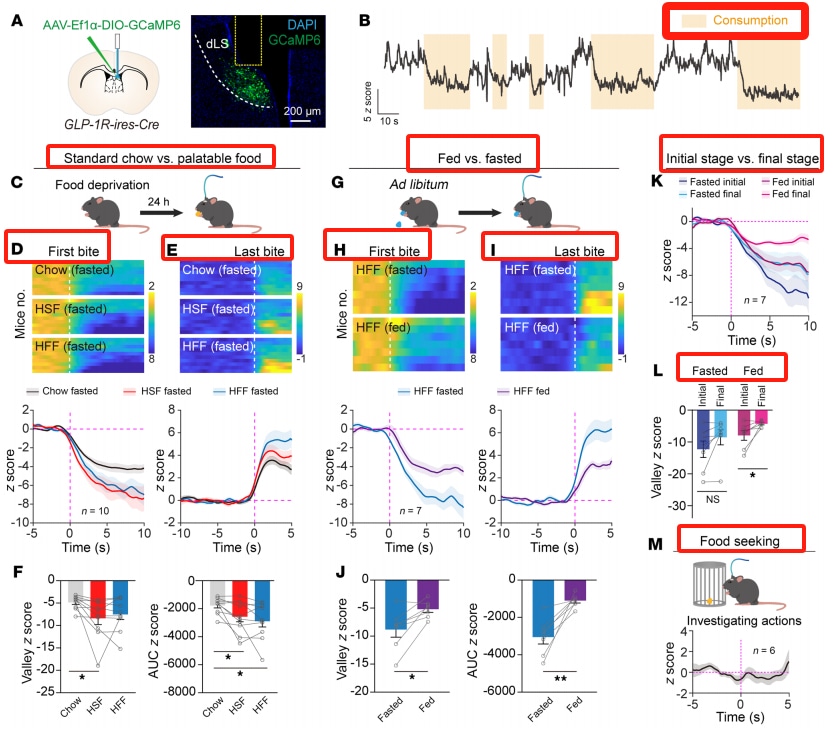
Le liraglutide active les neurones GLP-1R dans le septum latéral. L'immunohistochimie a révélé que les neurones positifs au GLP-1R sont densément distribués dans la partie dorsale du septum latéral (dLS). Après une injection intrapéritonéale de liraglutide, l'expression de c-Fos était élevée dans le LS, le noyau paraventriculaire (PVN) et l'aire caudale (AP). En croisant des souris GLP-1R-ires-Cre avec des souris rapporteuses Ai14, les neurones positifs au GLP-1R dans le LS ont été marqués, et il a été constaté que l'injection intrapéritonéale de liraglutide augmentait significativement l'expression de c-Fos dans ces neurones. La perfusion locale de liraglutide dans le LS a également eu le même effet, augmentant l'amplitude des courants postsynaptiques excitateurs.
L'inhibition du GLP-1R dans le LS affaiblit les effets du liraglutide
Grâce à la technologie CRISPR/Cas9, l'expression du GLP-1R a été spécifiquement supprimée dans les neurones positifs au GLP-1R dans le septum latéral dorsal (LSD). Le knock-out n'a pas affecté la prise alimentaire de base ou le poids corporel des souris, mais a affaibli les effets du liraglutide sur la prise alimentaire et la perte de poids. L'inactivation du GLP-1R dans le noyau paraventriculaire (PVN) et le noyau arqué (Arc) n'a pas modifié les effets anorexiques du liraglutide.
La surexpression du GLP-1R dans le noyau paraventriculaire réduit la consommation de nourriture chez les souris satiétogènes
La surexpression du GLP-1R dans le septum latéral dorsal (dLS) a réduit de manière significative la consommation de nourriture chez les souris à satiété, mais n'a pas eu d'effet sur la consommation de nourriture chez les souris à jeun. En outre, elle n'a pas modifié le poids corporel chronique ou les paramètres métaboliques.
L'inhibition des neurones GLP-1R du LS augmente la consommation alimentaire et favorise l'obésité
L'inhibition des neurones LS GLP-1R (par injection d'AAV exprimant la toxine tétanique) augmente la consommation d'aliments riches en graisses et le poids corporel, ainsi que la consommation d'aliments palatables. Cependant, cela n'affecte pas la tolérance au glucose ou la consommation d'eau, mais augmente la dépense énergétique et le rapport d'échange respiratoire. L'inhibition de ces neurones affaiblit l'effet du liraglutide sur la prise alimentaire et la perte de poids, mais n'affecte pas les nausées induites par le liraglutide.
L'activité des neurones LS GLP-1R diminue rapidement pendant l'alimentation
Les enregistrements par photométrie à fibres ont montré que, lorsque les souris privées de nourriture commençaient à manger, le signal Ca²⁺ des neurones LS GLP-1R diminuait de manière significative, revenant aux niveaux de base après l'arrêt de l'alimentation. La diminution était plus prononcée lorsque la nourriture était plus appétissante. Lorsque des aliments riches en graisses étaient présentés à des souris en état de satiété, la réponse inhibitrice était plus faible et l'inhibition pendant l'alimentation diminuait progressivement. Le comportement de recherche de nourriture n'a pas affecté l'activité neuronale.
L'activation des neurones LS GLP-1R réduit la consommation alimentaire
L'activation des neurones LS GLP-1R par chimiogénétique ou optogénétique peut réduire la prise alimentaire et supprimer l'appétit sans affecter l'homéostasie du glucose. Les neurones LS GLP-1R se projettent dans plusieurs régions du cerveau impliquées dans la régulation de l'alimentation.
5. Conclusion de la recherche
Le liraglutide active les neurones GLP-1R positifs dans le septum latéral, et les GLP-1R de cette région jouent un rôle important dans les effets anorexiques et réducteurs de poids du liraglutide. Les neurones GLP-1R LS jouent un rôle clé à la fois dans la satiété physiologique et dans les effets induits par le liraglutide, ce qui permet de mieux comprendre le mécanisme d'action du liraglutide et les points d'intervention ciblés potentiels pour le traitement de l'obésité.
Résultats de la recherche :
Approfondissement de la compréhension des mécanismes de l'obésité : Cette étude clarifie l'importance des neurones positifs au GLP-1R dans le septum latéral dans la régulation de l'homéostasie énergétique, contribuant ainsi à la compréhension des mécanismes neurobiologiques de l'obésité humaine. L'obésité est étroitement liée à des déséquilibres dans l'apport et la dépense d'énergie, et les voies neuronales révélées dans cette étude jouent un rôle critique, offrant une nouvelle perspective sur la physiopathologie de l'obésité.
Explication des mécanismes des effets secondaires des médicaments : L'étude a montré que les neurones GLP-1R du LS ne participent pas à la nausée induite par le liraglutide, ce qui suggère que d'autres régions du cerveau sont impliquées dans la réponse à la nausée. Cela permet d'expliquer pourquoi certains patients ressentent des effets secondaires tels que des nausées lorsqu'ils utilisent des agonistes du GLP-1R (par exemple, le liraglutide) pour traiter l'obésité ou le diabète, ce qui constitue une base théorique pour la poursuite de la recherche sur ces effets secondaires.
Identification de cibles médicamenteuses potentielles : La recherche met en évidence le rôle critique des GLP-1R dans le septum latéral dans les effets du liraglutide, suggérant que cette région ou ses neurones apparentés pourraient être des cibles potentielles pour traiter l'obésité et les maladies métaboliques associées. La mise au point de médicaments ciblant cette voie pourrait améliorer l'efficacité et la sécurité des traitements tout en réduisant les effets secondaires.
Optimisation des stratégies de traitement médicamenteux : Les résultats peuvent aider à mettre au point des méthodes de traitement médicamenteux plus précises, telles que la modulation de l'activité des neurones positifs au GLP-1R dans le septum latéral pour renforcer les effets anorexigènes et amaigrissants du liraglutide tout en évitant ou en réduisant les effets indésirables tels que les nausées. Cela ouvre la voie à une médecine personnalisée.
Promouvoir des approches thérapeutiques combinées : Étant donné que les GLP-1R dans différentes régions du cerveau peuvent travailler ensemble pour médier les effets du liraglutide, le développement futur de médicaments pourrait envisager de concevoir des stratégies de traitement combinées ciblant plusieurs voies ou régions du cerveau pertinentes pour améliorer l'efficacité des traitements de l'obésité et des maladies connexes.
Cette étude a utilisé le système de surveillance du métabolisme animal de Tow-Int Tech, qui mesure des paramètres tels que la consommation d'énergie, l'apport en oxygène (VO₂), la production de dioxyde de carbone (VCO₂), le rapport d'échange respiratoire, l'apport en nourriture et en eau, ainsi que d'autres paramètres métaboliques. Ce système permet un suivi à long terme chez les souris dans des conditions d'activité naturelle, fournissant des données pour l'étude des effets des médicaments ou de la modulation neuronale sur le métabolisme énergétique.
Mesure de la dépense énergétique (EE) :
La dépense énergétique est mesurée en surveillant la consommation d'oxygène (VO₂) et la production de dioxyde de carbone (VCO₂) des souris sur une période donnée dans le système de métabolisme énergétique, puis en calculant la dépense énergétique à l'aide de formules spécifiques. Cela permet de comprendre les changements dans la consommation d'énergie des souris dans différentes conditions expérimentales (par exemple, l'activation ou l'inhibition des neurones LS GLP-1R) et d'évaluer l'impact de ces manipulations sur le niveau global du métabolisme énergétique des souris.
Surveillance de la consommation d'oxygène (VO₂) et de la production de dioxyde de carbone (VCO₂) :
Les mesures en temps réel et en continu de la VO₂ et de la VCO₂ chez les souris dans le cadre du système de métabolisme énergétique fournissent des données sur les échanges gazeux dans différents états d'activité (tels que les périodes d'activité et de repos). L'étude a révélé que dans certaines conditions expérimentales (par exemple, après avoir réduit au silence les neurones LS GLP-1R), les niveaux de VO₂ et de VCO₂ étaient modifiés. Cela fournit des données essentielles pour analyser la relation entre l'activité neuronale et le métabolisme énergétique.
Calcul du taux d'échange respiratoire (RER) :
Le RER est le rapport entre la production de VCO₂ et la consommation de VO₂ et reflète l'utilisation métabolique des glucides et des lipides chez la souris. L'étude calcule le RER à l'aide de données provenant du système de métabolisme énergétique et constate que si VO₂ et VCO₂ changent dans certaines conditions (par exemple, après avoir réduit au silence les neurones LS GLP-1R), le RER, lui, ne change pas. Cela suggère que l'utilisation des substrats métaboliques par les souris n'a pas subi de changements substantiels dans ces conditions, ce qui nous permet d'approfondir notre compréhension de la régulation neuronale du métabolisme énergétique.
Mesure simultanée de l'apport alimentaire et hydrique :
Le système de métabolisme énergétique peut mesurer les paramètres du métabolisme énergétique tout en enregistrant simultanément la consommation de nourriture et d'eau des souris. Cela permet une analyse complète de l'équilibre entre l'apport et la dépense énergétiques, ainsi que des effets des différents traitements expérimentaux sur cet équilibre. Par exemple, lors de l'étude de la relation entre les manipulations des neurones LS GLP-1R et les changements dans la prise alimentaire, la combinaison des données sur la consommation d'énergie mesurée par la cage métabolique permet une compréhension plus complète du rôle de ces neurones dans la régulation de l'homéostasie énergétique.
Le système de surveillance du métabolisme animal de Tow-Int Tech a fourni des données complètes et continues sur le métabolisme énergétique des souris, ce qui est crucial pour révéler les mécanismes par lesquels les neurones LS GLP-1R régulent l'équilibre énergétique. Il apporte un soutien solide aux analyses et conclusions ultérieures.
Contactez nous maintenant !
Nous nous engageons à rendre votre recherche plus facile, plus précise et plus efficace et à vous aider à avoir confiance en vos données ! Nous avons fourni des services à un grand nombre de clients, ce qui nous a permis d'acquérir une riche expérience dans l'offre de solutions professionnelles personnalisées en fonction de vos besoins.