Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Actualités du secteur
L'aspartame : Un piège sucré ou un champ de mines pour la santé ?
La recherche montre que l'aspartame augmente l'insuline via le nerf vague, aggrave l'athérosclérose et que le knock-out de Cx3cr1 est une nouvelle cible thérapeutique.
Récemment, l'équipe de recherche dirigée par l'académicien Cao Yihai de l'Institut Karolinska en Suède a collaboré avec les équipes dirigées par les académiciens Zhang Yun, Zhang Cheng et le doyen Chen Yuguo de l'hôpital Qilu de l'université de Shandong. Ils ont publié un article de recherche intitulé "Sweetener aspartame aggravates atherosclerosis through insulin-triggered inflammation" (L'aspartame, édulcorant, aggrave l'athérosclérose par l'inflammation déclenchée par l'insuline) dans la revue Cell Metabolism. Cette étude souligne que l'aspartame peut exacerber l'apparition de l'athérosclérose et augmenter le risque de maladies cardiovasculaires. Si les édulcorants artificiels (comme l'aspartame) permettent de limiter l'apport en sucre et de réduire le stockage d'énergie, pourquoi provoquent-ils des maladies cardiovasculaires liées à l'accumulation de graisses ?
Contexte de la recherche
En juillet 2023, l'Organisation mondiale de la santé a classé l'aspartame, l'un des édulcorants artificiels les plus courants, dans le groupe 2B des substances cancérogènes. Bien entendu, le groupe 2B signifie seulement que l'aspartame est peut-être cancérogène pour l'homme, et les preuves de sa cancérogénicité pour l'homme sont limitées, de sorte qu'il n'y a pas lieu de paniquer outre mesure. Toutefois, outre le cancer, les liens entre les édulcorants artificiels et d'autres maladies ne cessent d'apparaître.
Objectifs de la recherche
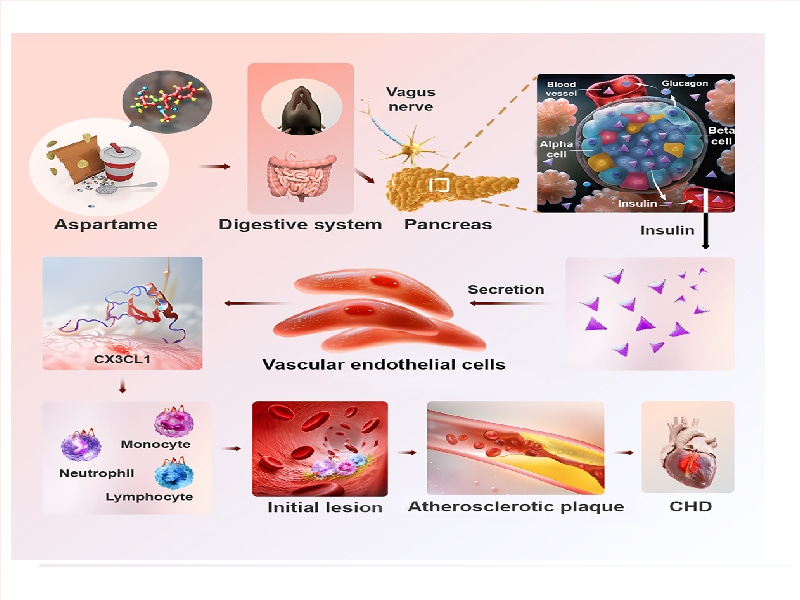
Cette étude vise à explorer l'association entre les édulcorants artificiels, en particulier l'aspartame, et les maladies cardiovasculaires. Elle se concentre sur l'analyse des mécanismes moléculaires spécifiques par lesquels les APM affectent l'athérosclérose, fournissant une base théorique et des cibles thérapeutiques potentielles pour la prévention et le traitement des maladies cardiovasculaires.
Figure 1 : Mécanismes moléculaires spécifiques par lesquels l'APM affecte l'athérosclérose
Méthodes expérimentales
Modèles de souris : Souris ApoE-/- et souris Cx3cr1 MΦ-/-/ApoE -/- doublement knock-out, toutes nourries avec un régime riche en graisses et en cholestérol (HFCD)
Modèle de singe cynomolgus : Des singes cynomolgus mâles de quatre ans ont été utilisés. De l'APM ou du saccharose ont été ajoutés à leur eau de boisson pour simuler le scénario de la consommation d'édulcorants chez l'homme. Les changements dans les indicateurs tels que l'insuline, le glucose et le peptide C dans le sang ont été détectés pour vérifier si l'effet de l'APM sur la sécrétion d'insuline constaté dans le modèle murin existe également chez les primates, ce qui renforce la fiabilité et l'universalité des résultats de la recherche.
Moyens techniques
Technologie d'édition de gènes : Des technologies telles que CRISPR-Cas9 ont été utilisées pour construire des modèles de souris génétiquement modifiées. Par exemple, des sites LoxP ont été insérés de part et d'autre du gène Cx3cr1, puis croisés avec des souris Lyz2-Cre pour neutraliser le gène Cx3cr1 dans les monocytes/macrophages et étudier sa fonction.
Techniques de biologie moléculaire : Le séquençage de l'ARN a été utilisé pour analyser le profil d'expression génique des PAEC stimulés par l'insuline afin de trouver des molécules de signalisation potentielles ; la qPCR a été utilisée pour mesurer les niveaux d'ARNm de gènes spécifiques (tels que Cx3cl1) ; le Western blot a été utilisé pour détecter l'expression de protéines apparentées (telles que CX3CL1 et CX3CR1) afin d'explorer les schémas de changement des molécules apparentées lorsque l'APM a un effet sur l'athérosclérose.
Techniques de biologie cellulaire : La technique de culture de cellules primaires a été utilisée pour isoler et cultiver des PAEC de souris et des macrophages primaires afin d'étudier in vitro les interactions cellule-cellule et la transduction des signaux. Grâce à des expériences de chambres d'écoulement à plaques parallèles et de chambres de Boyden, l'adhésion entre les monocytes et les cellules endothéliales et la capacité de migration des monocytes ont été étudiées afin d'explorer l'effet de la voie de signalisation CX3CL1-CX3CR1 sur les fonctions cellulaires.
Techniques de détection métabolique : Le système de détection du métabolisme énergétique animal a été utilisé pour mesurer les paramètres du métabolisme respiratoire des souris, notamment la consommation d'oxygène, la production de dioxyde de carbone, la production de chaleur, etc., afin d'évaluer l'effet métabolique global de l'APM sur les souris ; le test de tolérance au glucose (GTT) et le test de tolérance à l'insuline (ITT) ont été utilisés pour détecter la sensibilité à l'insuline des souris afin de déterminer si l'APM entraîne une résistance à l'insuline.
Séquençage d'une seule cellule : Il a été utilisé pour analyser les caractéristiques de la population et les différences d'expression génique des monocytes du sang périphérique (PBMC) chez les souris Cx3cr1 lox/lox et Cx3cr1 MΦ-/-, afin de comprendre en profondeur les changements et les mécanismes d'action des différentes populations cellulaires au cours du processus de l'APM affectant l'athérosclérose.
Résultats expérimentaux
1. L'APM exacerbe l'athérosclérose chez les souris :
Après avoir nourri des souris ApoE-/- avec différentes doses d'APM pendant 12 semaines, les plaques d'athérosclérose (PA) dans l'aorte du groupe nourri à l'APM ont augmenté de manière significative et ont montré une relation dose-dépendante. L'expérience temporelle a montré que lorsque les souris étaient nourries avec de l'APM pendant 4 semaines, le nombre de lésions athérosclérotiques et la taille moyenne des plaques augmentaient, et qu'ils augmentaient encore à 8 semaines et 12 semaines. Le groupe témoin nourri avec 15 % de saccharose n'a pas montré de développement évident des lésions athérosclérotiques à 4 et 8 semaines, et l'effet promoteur n'est apparu qu'à 12 semaines. L'alimentation avec des APM n'a pas affecté le poids corporel, la composition de la masse grasse, la prise alimentaire et la plupart des paramètres métaboliques des souris. Seule l'alimentation avec du saccharose a légèrement augmenté le poids corporel et la composition de la masse grasse des souris, et le taux de LDL sérique a légèrement diminué.
Figure 2 : L'APM exacerbe l'athérosclérose chez les souris
2. L'APM augmente les niveaux d'insuline plasmatique et régule l'insuline par l'intermédiaire du nerf vague : souris :
Après avoir nourri des souris avec différentes concentrations d'APM, les niveaux d'insuline plasmatique ont augmenté de manière significative dans les 30 minutes. L'administration continue de 0,15 % d'APM pendant 12 semaines a entraîné une augmentation continue du taux d'insuline sérique et les souris ont développé une résistance à l'insuline. L'expérience sur le singe cynomolgus a également montré qu'après une alimentation avec 0,15 % d'APM ou 15 % de saccharose pendant 10 minutes, les taux d'insuline augmentaient transitoirement après 30 minutes et revenaient à la normale après 60 minutes, et les taux d'insuline dans le groupe APM et le groupe saccharose étaient similaires, mais les changements dans les taux de glucose sanguin étaient opposés. La vagotomie sous-diaphragmatique bilatérale (SDV) pouvait complètement inhiber la production d'insuline et l'athérosclérose induite par l'APM.
Figure 3 : L'APM augmente les taux d'insuline plasmatique et régule l'insuline par l'intermédiaire du nerf vague
3. Étude mécaniste de l'athérosclérose insulino-dépendante :
Implantation d'une micropompe libérant de l'insuline dans des souris ApoE-/- pour simuler l'augmentation des niveaux d'insuline circulante chez l'homme. Après 4 semaines, la formation, la croissance et l'instabilité des AP étaient exacerbées, ce qui était similaire à l'effet de l'alimentation en APM. L'utilisation de la streptozotocine (STZ) pour éliminer la production d'insuline pancréatique a permis de contrecarrer complètement la formation, la croissance et l'instabilité accrues des AP causées par l'APM, ce qui démontre que l'augmentation de l'insuline est une condition nécessaire pour que l'APM exacerbe l'athérosclérose.
Figure 4 : Étude mécaniste de l'athérosclérose insulino-dépendante
4. CX3CL1 est une chimiokine endothéliale artérielle stimulée par l'insuline :
Après stimulation par l'insuline des cellules endothéliales aortiques primaires (PAEC) pendant 8 heures, l'analyse RNA-seq a montré que Cx3cl1 était le gène le plus significativement régulé, et la qPCR et le Western blot ont vérifié la forte expression de son ARNm et de sa protéine. Des expériences in vivo ont montré que les niveaux de CX3CL1 circulant et lié à la membrane des cellules endothéliales vasculaires chez les souris nourries à l'APM augmentaient de manière significative, et que cette augmentation dépendait de l'insuline.
Figure 5 : CX3CL1 est une chimiokine endothéliale artérielle stimulée par l'insuline
5. Effets chimiotactiques et adhésifs de CX3CL1-CX3CR1 sur les monocytes/macrophages :
Dans les monocytes RAW264.7, la protéine CX3CR1 est fortement exprimée. L'inhibition de CX3CR1 à l'aide d'un shRNA peut inhiber l'adhésion des monocytes stimulés par l'insuline aux PAEC. L'expérience de la chambre d'écoulement à plaques parallèles a montré que la stimulation des PAEC par l'insuline pouvait augmenter l'adhésion des monocytes, et que l'inhibition de CX3CR1 pouvait inhiber cet effet. En outre, la voie de signalisation CX3CL1-CX3CR1 peut également induire la migration des monocytes et la polarisation des macrophages M0 en macrophages M1.
Figure 6 : Effets chimiotactiques et adhésifs de CX3CL1-CX3CR1 sur les monocytes/macrophages
6. La suppression du gène Cx3cr1 réduit la population de cellules myéloïdes pro-inflammatoires :
En construisant des souris Cx3cr1 MΦ-/-, l'analyse par séquençage de l'ARN d'une seule cellule (scRNA-seq) a montré que la population de cellules myéloïdes était significativement réduite, les sous-populations de monocytes/macrophages ont changé, la sous-population Mono-c1 a diminué, et les sous-populations Mono-c3 et Macro-c5 ont augmenté. L'analyse pseudo-temporelle a montré que l'axe de signalisation CX3CL1-CX3CR1 affectait la différenciation des monocytes.
Figure 7. scRNA-seq des PBMCs chez les souris Cx3cr1MΦ-/-
7. La perte de fonction du gène Cx3cr1 dans les monocytes/macrophages contrecarre l'athérosclérose exacerbée par l'APM :
Par rapport au groupe témoin, la formation et la croissance accrues des AP causées par l'APM ont été complètement contrecarrées chez les souris doublement knockout Cx3cr1 MΦ-/-/ApoE -/-. Au stade précoce (4 semaines) du développement de l'AP, la suppression du gène Cx3cr1 a significativement inhibé la formation des lésions, et l'effet anti-athérosclérotique était plus évident à 8 semaines et 12 semaines.
Figure 8. La perte génétique de la fonction de Cx3cr1 dans les monocytes/macrophages neutralise l'athérosclérose exacerbée par l'APM
Conclusion de la recherche
L'étude a montré que l'aspartame peut augmenter les niveaux d'insuline en activant le nerf parasympathique, exacerbant ainsi l'athérosclérose, et que ce processus est dépendant de l'insuline et implique la voie de signalisation CX3CL1-CX3CR1.
L'élimination du gène Cx3cr1 dans les monocytes/macrophages peut contrer l'athérosclérose exacerbée par l'aspartame, ce qui constitue une nouvelle cible pour le traitement des maladies cardiovasculaires associées.
Dans cette étude, le système de métabolisme énergétique animal a été utilisé pour surveiller la consommation d'oxygène, la production de dioxyde de carbone, la production de chaleur et d'autres indicateurs chez les souris, fournissant des données clés pour explorer la relation entre l'aspartame et l'athérosclérose, indiquant que la surveillance du métabolisme énergétique joue un rôle important dans la recherche sur les sciences de la vie.
Notre société, Tow-Int Tech, a développé de manière indépendante un système de détection du métabolisme énergétique des animaux, qui peut être utilisé pour la surveillance et l'enregistrement en temps réel des indicateurs métaboliques et moteurs des petits animaux, et qui peut mesurer et analyser qualitativement et quantitativement les activités comportementales des animaux et leurs interactions avec le métabolisme respiratoire. Les indicateurs détectés comprennent la consommation d'oxygène, la production de CO2, le rapport d'échange respiratoire RER, la consommation d'énergie EE, la consommation de nourriture, la consommation d'eau, le mouvement tridimensionnel XYZ, le poids corporel, l'activité de la roue de course et d'autres indicateurs.
Références :
[1] Wu W, Sui W, Chen S, et al. L'édulcorant aspartame aggrave l'athérosclérose par le biais d'une inflammation déclenchée par l'insuline [J]. Cell Metabolism, 2025.
Contactez-nous !
Nous nous engageons à faciliter vos recherches, à les rendre plus précises et plus efficaces et à vous aider à avoir confiance en vos données ! Nous avons fourni des services à un grand nombre de clients et possédons une riche expérience dans l'offre de solutions professionnelles personnalisées en fonction de vos besoins.