Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Tendances produits
{{{sourceTextContent.title}}}
Le passé et le présent de PARPis
{{{sourceTextContent.subTitle}}}
Le passé et le présent de PARPis
{{{sourceTextContent.description}}}
En 2014, le premier inhibiteur de PARP, l'Olaparib (Olaparib), a été lancé. Il s'agit du premier médicament commercialisé selon le concept de la létalité synthétique, qui a ouvert une nouvelle voie pour la thérapie ciblant les tumeurs.
Les inhibiteurs de PARP et leur mécanisme
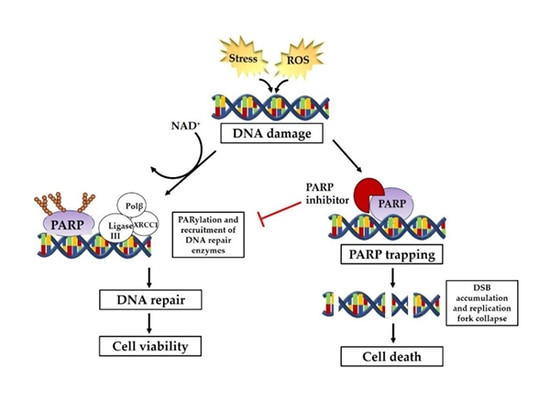
Le nom complet des inhibiteurs de PARP est inhibiteurs de la polyadénosine diphosphate ribose polymérase.
En 1922, Calvin Bridges, un généticien travaillant au laboratoire Morgan de l'université de Columbia, a découvert que l'inactivation par mutation de deux gènes spécifiques de la drosophile en même temps entraînait la mort de la drosophile, alors que l'inactivation par mutation d'un seul de ces deux gènes n'entraînait pas de dommages mortels pour la drosophile. La "létalité synthétique" signifie que pour deux gènes dans une cellule, si l'un d'entre eux est muté seul ou ne fonctionne pas, il n'entraînera pas la mort de la cellule ; et si les deux sont mutés ou ne peuvent pas être exprimés, cela entraînera la mort de la cellule. Ce principe permet de tuer sélectivement les cellules tumorales sans affecter les cellules somatiques normales.
En 2005, deux études publiées simultanément par Nature ont confirmé pour la première fois l'existence d'un effet létal synthétique entre les inhibiteurs de PARP et les mutations BRCA1/2.
Les voies impliquées dans la réparation de l'ADN comprennent principalement la réparation des cassures simple brin (SSBR) et la réparation des cassures double brin (DSBR). Les mécanismes de réparation comprennent principalement la recombinaison homologue (HR), la jonction non homologue (NHEJ), la réparation par excision des bases (BER), la réparation par excision des nucléotides (NER), la réparation des mésappariements (MMR) et la synthèse des translésions, etc. Parmi elles, la réparation de l'ADN simple brin dépend de la voie de réparation médiée par la PARP. Lorsque l'ADN simple brin est endommagé, la PARP se rassemble sur le site de la cassure simple brin de l'ADN et est activée, recrutant ainsi une série de complexes pour participer à la réparation de l'ADN. Les inhibiteurs de PARP inhibent l'activité de l'enzyme PARP pour l'empêcher de fonctionner en formant des polymères PAR pour attirer les protéines liées à la réparation des lésions de l'ADN. La réparation par recombinaison homologue (HRR) est la méthode de réparation privilégiée pour les cassures double brin de l'ADN. Les patients présentant un déficit de réparation par recombinaison homologue (HRD) causé par des mutations du gène HRR, y compris des mutations BRCA dans les cellules cancéreuses, des mutations germinales, des mutations somatiques de gènes apparentés réparés par recombinaison homologue, une inactivation épigénétique et de nombreux autres facteurs, perdent la fonction de réparation des cassures double brin de l'ADN, ce qui entraîne l'impossibilité de réparer les cellules cancéreuses à la fois sur un et deux brins afin d'obtenir une létalité de synthèse.
Inhibiteurs de PARP approuvés
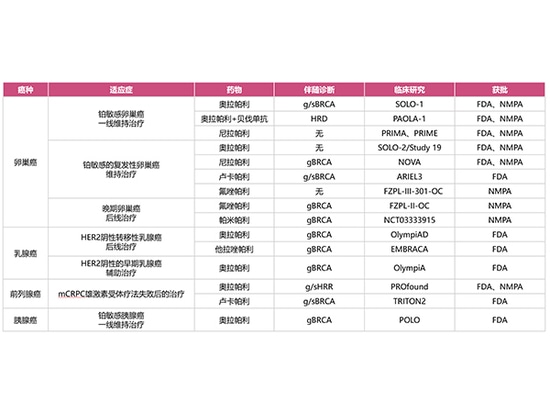
À l'heure actuelle, la FDA américaine a approuvé quatre inhibiteurs de PARP (Olaparib, Niraparib, Rucaparib et Talazoparib), tandis que la NMPA chinoise a approuvé quatre inhibiteurs de PARP (Olaparib, Niraparib, Fluzoparib, Pamiparib), qui ont été appliqués cliniquement au cancer de l'ovaire, au cancer du sein, au cancer du pancréas et au cancer de la prostate.
Indications applicables approuvées par la FDA :
Orapali :
Il est utilisé pour le traitement d'entretien des patientes atteintes d'un cancer de l'ovaire avancé muté BRCA g/s qui ont obtenu une RC/PR après une chimiothérapie de première intention à base de platine ;
Pour le traitement d'entretien des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine qui ont obtenu une RC/PR après une chimiothérapie de première intention à base de platine ;
Pour le traitement d'entretien combiné avec le bevacizumab des patientes atteintes d'un cancer de l'ovaire avancé HRD-positif qui ont obtenu une CR/PR après une chimiothérapie de première intention à base de platine ;
Pour le traitement adjuvant des patientes adultes atteintes d'un cancer du sein précoce à haut risque HER2-négatif muté gBRCA et ayant reçu une chimiothérapie néoadjuvante ou adjuvante ;
Pour le traitement des patientes adultes atteintes d'un cancer du sein métastatique mutant gBRCA, HER2-négatif, ayant reçu une chimiothérapie néoadjuvante ou adjuvante ;
Pour le traitement d'entretien des patients atteints d'un adénocarcinome pancréatique métastatique qui n'ont pas progressé après une chimiothérapie de première intention à base de platine pendant au moins 16 semaines et qui présentent des mutations gBRCA ;
Pour le traitement des patients adultes atteints d'un cancer de la prostate métastatique résistant à la castration avec mutation du gène g/s HRR (mCRPC) qui a progressé après avoir reçu de l'enzalutamide ou de l'abiratérone avant la thérapie de base.
Nirapali
Il est utilisé pour le traitement d'entretien de première intention des patientes atteintes d'un cancer de l'ovaire avancé qui ont obtenu une RC/PR avec une chimiothérapie de première intention à base de platine ;
Pour le traitement d'entretien des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine
Lucapali
Il est utilisé pour le traitement d'entretien des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine ;
Pour le traitement des patients adultes atteints d'un cancer de la prostate métastatique résistant à la castration (mCRPC) qui ont déjà reçu une thérapie ciblant les récepteurs des androgènes et une chimiothérapie à base de taxanes et qui présentent des mutations du gène BRCA.
Talazoparib
Il est utilisé pour le traitement des patients atteints d'un cancer du sein localement avancé ou métastatique avec mutation du gène BRCA et HER2 négatif.
Indications applicables approuvées par le NMPA :
Orapali
Il est utilisé pour le traitement d'entretien des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine ;
Pour le traitement d'entretien de première intention des patientes atteintes d'un cancer de l'ovaire avancé avec mutation BRCA ;
Pour le traitement d'entretien de première ligne associé au bevacizumab chez les patientes atteintes d'un cancer de l'ovaire avancé nouvellement diagnostiqué qui ont obtenu une rémission complète ou partielle après une chimiothérapie à base de platine et qui sont séropositives pour le cancer de l'ovaire ;
En monothérapie pour les patients adultes atteints d'un cancer de la prostate métastatique résistant à la castration et porteurs de mutations BRCA1/2 (germinales et/ou somatiques) et dont la maladie a progressé après un traitement antérieur par de nouveaux médicaments hormonaux.
Nirapali
Il est utilisé pour le traitement d'entretien des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine après qu'une chimiothérapie contenant du platine a permis d'obtenir une rémission complète ou partielle ;
Pour le traitement d'entretien de première intention des patientes atteintes d'un cancer de l'ovaire avancé qui ont obtenu une réponse complète ou partielle à une chimiothérapie de première intention à base de platine.
Fluzoparib
Il est utilisé pour le traitement des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine et présentant une mutation gBRCA, qui ont reçu une chimiothérapie de deuxième intention ou plus ;
Pour le traitement d'entretien des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine après une rémission complète ou partielle d'une chimiothérapie à base de platine.
Pamipali
Il est utilisé pour le traitement des patientes atteintes d'un cancer de l'ovaire avancé, d'un cancer des trompes de Fallope ou d'un cancer péritonéal primaire qui ont reçu au moins deux lignes de chimiothérapie et qui présentent une mutation gBRCA.
Indications applicables retirées par la FDA :
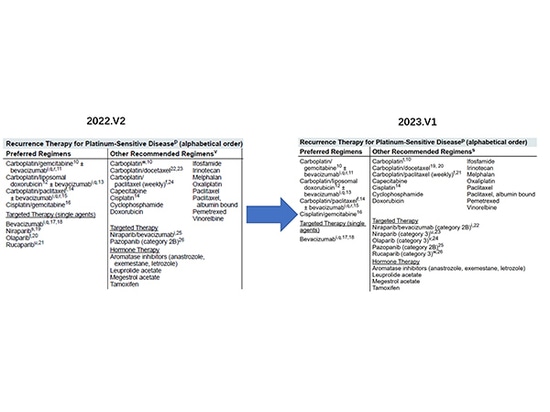
Avec la mise à jour continue de la recherche clinique, les données cliniques montrent que le risque de décès des patients atteints de cancer de l'ovaire utilisant le lucaparib, l'olaparib et le niraparib a augmenté, de sorte que la FDA a retiré certaines des indications pertinentes, dont le rétrécissement des indications pour le traitement d'entretien de deuxième ligne par le niraparib est le plus notable, et les lignes directrices du NCCN ont également été ajustées à temps pour supprimer la recommandation correspondante et abaisser le niveau de la recommandation.
1. En juin 2022, la FDA a retiré le rucaparib du traitement de deuxième intention des patientes atteintes d'un cancer de l'ovaire muté BRCA.
2. En août 2022, la FDA a retiré l'olaparib du traitement de dernière intention des patientes atteintes d'un cancer de l'ovaire avancé avec mutations BRCA.
3. En septembre 2022, la FDA a retiré le niraparib pour le traitement de dernière ligne des patientes adultes présentant des mutations BRCA, un cancer épithélial de l'ovaire récurrent HRD-positif et sensible au platine, un cancer des trompes de Fallope ou un cancer péritonéal primaire.
4. En novembre 2022, la FDA a retiré certaines indications du traitement d'entretien au niraparib pour les patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine.
En mars 2021, les données de SG (survie globale) d'une étude NOVA utilisant le niraparib comme traitement d'entretien chez des patientes atteintes d'un cancer de l'ovaire récurrent sensible au platine ont montré que pour les patientes présentant des mutations non BRCA, la SG médiane dans le groupe niraparib était de 31,1 mois, contre 36,5 mois dans le groupe témoin, ce qui signifie que le traitement d'entretien par le niraparib n'apporte pas de bénéfice en termes de SG. Dans les résultats finaux de l'étude NOVA sur la SG, le rapport de risque de SG pour les patients ne présentant pas de mutation de l'ACRB était de 1,10 (IC à 95 % : 0,831-1,459).
En septembre 2022, l'American Society of Clinical Oncology (ASCO) a publié "PARP Inhibitor Ovarian Cancer Management : ASCO Guideline Rapid Recommendation Update", qui soulignait que pour les patientes atteintes d'un cancer de l'ovaire récurrent non muté BRCA, le traitement d'entretien par le niraparib devait être évalué entre le bénéfice potentiel en termes de SSP (survie sans progression) et la baisse de la SG.
Aujourd'hui, avec le retrait des indications partielles des inhibiteurs de PARP, l'utilisation clinique des inhibiteurs de PARP est relativement calme et il existe également une demande de conseils précis en matière de médication.
Résumé
Les inhibiteurs de PARP sont des médicaments ciblés qui exercent des effets antitumoraux par le biais de l'effet "létal synthétique" sur la base de la DRH. Leur avènement a modifié le modèle de traitement du cancer de l'ovaire, faisant de la thérapie d'entretien une partie importante de la gestion globale du cancer de l'ovaire, ce qui a une signification importante.
Dans la pratique clinique, les indications pour l'utilisation des inhibiteurs de la PARP doivent être strictement comprises. Il est recommandé de détecter systématiquement les mutations du gène BRCA avant le traitement, et de procéder à la détection du gène HRD si les conditions le permettent, afin d'orienter avec précision le traitement clinique et d'évaluer le pronostic.
Parmi les indications des inhibiteurs de PARP, outre le cancer du sein, le cancer de l'ovaire, le cancer des trompes de Fallope, etc., le cancer de la prostate, qui est également un cancer de la reproduction, suscite également un grand enthousiasme en matière de recherche et de développement, et la thérapie combinée est également un point chaud de la recherche. À l'avenir, au fur et à mesure que les essais cliniques se termineront, les scénarios d'application clinique des inhibiteurs de PARP et des marqueurs moléculaires associés deviendront de plus en plus clairs.
références :
1. Lignes directrices pour l'application clinique des inhibiteurs de PARP dans le cancer de l'ovaire (édition 2022)
2. Nature. 2012 Jan 18;481(7381):287-94.
3. J Clin Med. 2019 Mar 30;8(4):435.
4. Site officiel de la FDA
5. Site officiel des NMPA
6. Lignes directrices du NCCN

{{medias[54624].description}}