#Tendances produits
La valeur d'application de la méthylation du cancer du poumon dans le diagnostic précoce du cancer du poumon
La perspective de la détection de la méthylation du cancer du poumon.
Selon les statistiques de l'Organisation mondiale de la santé, le cancer du poumon est la principale cause de décès par cancer dans le monde, avec un taux d'incidence de 11,4 % et un taux de mortalité de 18,0 %. En Chine, le cancer du poumon a le taux d'incidence le plus élevé parmi les tumeurs malignes. L'adénocarcinome pulmonaire (LUAD) est le sous-type histologique le plus courant de cancer du poumon non à petites cellules (NSCLC), représentant environ 40 % des cas de cancer du poumon. La résection chirurgicale du NSCLC à un stade précoce offre un bon pronostic, avec un taux de survie à 5 ans de 70 à 90 % (stade I), mais la plupart des patients (environ 75 %) sont diagnostiqués à un stade tardif (stade III/IV) et ont un faible taux de survie. Avec le développement des technologies de séquençage, des schémas anormaux de méthylation de l'ADN ont été découverts dans diverses tumeurs et sont considérés comme une cause importante de cancer. La méthylation est généralement présente dans les séquences d'ADN hautement et modérément répétitives et joue un rôle clé dans l'instabilité chromosomique. Une méthylation élevée des régions promotrices des gènes suppresseurs de tumeurs est souvent associée au silençage génique. La méthylation de l'ADN est impliquée dans les premiers stades de la formation de la tumeur. De plus, la méthylation de l'ADN est relativement stable dans le temps et peut être détectée de manière non invasive dans le sang, l'urine, la salive et d'autres fluides corporels. Par conséquent, un nombre croissant de biomarqueurs de méthylation ont été développés pour le dépistage et le diagnostic précoces des tumeurs. Des études nationales[1] ont montré que la détection combinée de la méthylation de SHOX2 et de RASSF1A dans le liquide de lavage bronchoalvéolaire a une efficacité diagnostique globale significativement plus élevée pour le cancer du poumon que l'examen cytologique et l'antigène carcinoembryonnaire biomarqueur sérique. Une autre étude a montré que lorsque les deux gènes étaient détectés par PCR spécifique à la méthylation, les taux de détection de l'adénocarcinome pulmonaire et du carcinome épidermoïde chez les individus ayant des résultats positifs étaient de 66,0 % et 90,9 %, respectivement. Cela indique la valeur significative de la détection de la méthylation SHOX2 et RASSF1A dans le diagnostic précoce du cancer du poumon.
La fonction et les maladies associées du gène RASSF1A
La famille de domaines d'association RAS (RASSF) se compose de 10 membres, de RASSF1 à RASSF10. Ces protéines sont caractérisées par le domaine d'association RAS (RA), qui peut être trouvé à l'extrémité C-terminale (par exemple, RASSF16, connue sous le nom de protéine C-RASSF) ou N-terminale (par exemple, RASSF7-10, connue sous le nom de N- protéines RASSF). RASSF1 et RASSF5 sont des membres largement et significativement étudiés de cette famille de protéines, alors que peu de données sont disponibles sur les autres membres.
RASSF1A et RASSF1C sont largement exprimés dans les tissus normaux et sont situés sur les microtubules, participant à la régulation de la croissance. Leurs rôles dans le cancer sont presque opposés, le premier jouant un rôle suppresseur de tumeur et le second jouant un rôle crucial dans la carcinogenèse. Le silence transcriptionnel de RASSF1A par une méthylation élevée perturbe l'équilibre entre les deux, entraînant une surexpression de RASSF1C et guidant sa fonction dans le développement du cancer. Selon les données pertinentes, la méthylation du promoteur RASSF1A se produit à une fréquence pouvant atteindre 88 % dans le cancer du poumon, alors qu'il est presque non méthylé dans les tissus environnants normaux. La fréquence de méthylation du promoteur RASSF1A atteint près de 100 % dans le cancer du poumon à petites cellules (SCLC) et 65 % dans le cancer du poumon non à petites cellules (NSCLC).
La fonction et les maladies associées du gène SHOX2
La protéine SHOX est principalement distribuée dans les membres, le cœur, le nez, les arcs branchiaux, le système nerveux et la partie médiane à distale du tubercule génital embryonnaire humain. SHOX2 est relativement proche des membres. De plus, SHOX2 est également exprimé dans la placode nasale, le substrat du système nerveux central, les ganglions de la racine dorsale, les voies d'afflux cardiaques, le troisième arc pharyngé et les structures dérivées. Le gène SHOX régule principalement le développement des structures corporelles embryonnaires précoces et le système de stimulation cardiaque. Les mutations du gène SHOX entraînent généralement une perte d'expression et peuvent entraîner le syndrome de petite taille.
SHOX2 inhibe l'apoptose et active la voie NF-kB en augmentant RUNX2 pour supprimer l'activité de p53, entraînant ainsi l'apparition de processus cancérigènes.
RASSF1A est un facteur de régulation clé de la voie Hippo et relie cette voie aux voies de signalisation TNF-α, NF-kB et TGF-β. En coopération avec les cytokines inflammatoires, P53 et K-RAS, la perte épigénétique de RASSF1A relie une série de voies importantes de signalisation du cancer et joue un rôle important dans l'apparition et la métastase du cancer. En raison de sa relation complexe avec certains microARN, SHOX2 peut interagir avec les voies Hippo, EMT, RAS/ERK MAPK et PI3K/AKT, qui sont essentielles pour la tumorigenèse, les métastases et l'apparition du cancer du poumon.
SHOX2 peut se lier aux récepteurs TGF et interagir avec la voie NF-kB, indiquant une relation de régulation mutuelle avec RASSF1A.[2]
Sensibilité et spécificité de la méthylation SHOX2 et RASSF1A dans les études cliniques
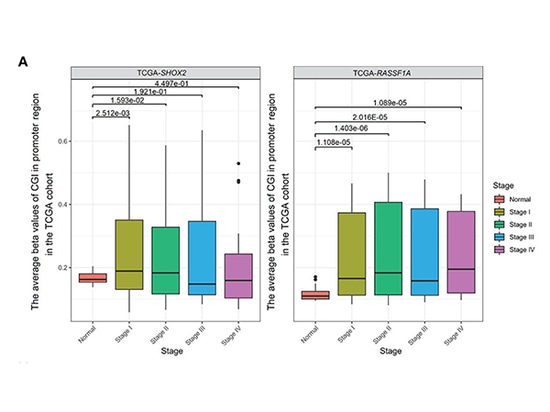
La méthylation combinée des promoteurs SHOX2 et RASSF1A a été déterminée dans des échantillons de 54 patients LUAD à un stade précoce et de 31 patients atteints de nodules pulmonaires bénins à l'hôpital Nanjing Drum Tower. Les résultats ont montré que le niveau de détection de la méthylation du promoteur SHOX2 dans les échantillons de tumeurs des patients LUAD était légèrement supérieur à celui de RASSF1A. Il a été constaté que la détection de la méthylation du promoteur SHOX2 ou RASSF1A était sensible et spécifique pour le LUAD à un stade précoce, mais l'efficacité diagnostique de la détection de la méthylation d'un seul gène n'était pas élevée. Le potentiel diagnostique de la détection combinée de la méthylation du promoteur pour les patients de stade 0 n'est toujours pas clair. Au fur et à mesure que le stade de la maladie augmentait du stade 0-II ou que LUAD progressait de l'AIS (adénocarcinome in situ) au MIA (adénocarcinome mini-invasif) puis à l'IPA (adénocarcinome invasif), les niveaux de méthylation du promoteur SHOX2 ou RASSF1A augmentaient progressivement. Les patients avec des résultats positifs dans la détection combinée de la méthylation peuvent avoir des tumeurs à évolution rapide et nécessiter un traitement actif. De plus, l'analyse de la cohorte TCGA a montré que SHOX2 n'a pas augmenté de manière significative du stade III au stade IV. Cela peut indiquer que l'hyperméthylation du promoteur SHOX2 est un biomarqueur pour le LUAD à un stade précoce, mais pas pour le LUAD à un stade avancé [3].
Comparaison de la méthylation entre les échantillons normaux et tumoraux des stades I à IV dans la cohorte TCGA
Les niveaux de méthylation de SHOX2 et RASSF1A ont été détectés dans des échantillons de résection FFPE de 251 patients à l'hôpital de Tongji, à l'université de Tongji. Parmi eux, 137 cas ont été diagnostiqués avec un cancer du poumon, dont 70 adénocarcinomes, 51 carcinomes épidermoïdes et 16 cancers du poumon à petites cellules. 114 autres cas étaient des maladies bénignes comme témoins. De plus, 17 échantillons de biopsie de patients atteints de cancer du poumon ont été analysés. Pour tous les échantillons, les caractéristiques cliniques liées à la classification histologique et au stade tumoral confirmé par la pathologie ont été analysées.
Méthylation de SHOX2 et RASSF1A dans différents sous-types histologiques et groupes de stadification tumorale
Les taux de détection positifs de SHOX2 et RASSF1A étaient de 100,0 %, 96,1 %, 82,9 % et 89,8 %, respectivement, dans le cancer du poumon à petites cellules, le carcinome épidermoïde, l'adénocarcinome et tous les cancers. Dans le groupe témoin, 11 des 114 patients atteints de maladies pulmonaires bénignes ont été détectés positifs pour SHOX2 ou RASSF1A, avec une spécificité de 90,4 %. La sensibilité de la détection du SCC était de 94,1 % pour SHOX2 seul. Combiné avec RASSF1A, les taux de détection de l'adénocarcinome et du cancer du poumon à petites cellules sont passés de 64,3 % et 87,5 % à 82,9 % et 100 %, respectivement. Une sensibilité plus faible de SHOX2 a été observée uniquement dans l'adénocarcinome de stade I. L'étude a également révélé que le degré de méthylation de SHOX2 était lié à la stadification du cancer du poumon, augmentant du stade I au stade IV, alors qu'aucune corrélation de ce type n'a été observée pour la méthylation de RASSF1A dans les cas de cancer du poumon. De plus, SHOX2 ou RASSF1A hautement méthylés ont été détectés non seulement dans 16 échantillons chirurgicaux, mais également dans 11 échantillons de biopsie histopathologiquement négatifs parmi 17 échantillons de biopsie. Cela indique que les biomarqueurs de méthylation ont une sensibilité plus élevée par rapport aux résultats pathologiques et peuvent considérablement améliorer l'efficacité du diagnostic[4].
Potentiel de détection de la méthylation pour le diagnostic précoce du cancer du poumon
Actuellement, le diagnostic pathologique de routine appartient en grande partie à la "science empirique" et est hautement subjectif. Le diagnostic pathologique (y compris l'examen cytologique et histopathologique) peut être gravement affecté par la qualité des échantillons et le niveau de diagnostic des pathologistes. La sensibilité et la reproductibilité de la détection doivent être améliorées et renforcées. Les méthodes de diagnostic moléculaire émergentes sont plus sensibles et objectives et peuvent surmonter les lacunes inhérentes au diagnostic morphologique. Les modifications de la méthylation de l'ADN sont l'un des biomarqueurs les plus prometteurs pour le diagnostic précoce du cancer et ont été transférées de la recherche scientifique aux applications cliniques. De nombreuses études ont rapporté divers biomarqueurs de méthylation de l'ADN et confirmé leur rôle dans le diagnostic du cancer du poumon. La détection combinée de la méthylation de RASSF1A et de SHOX2, avec sa sensibilité et sa spécificité élevées, peut fournir des biomarqueurs sans précédent pour le dépistage du cancer du poumon et le suivi de la progression. Une meilleure compréhension des fonctions biologiques de RASSF1A et SHOX2 grâce à la recherche et à l'amélioration de leurs méthodes de détection peut aider à mieux les utiliser dans la pratique clinique. L'application de ces biomarqueurs devrait améliorer la précision du dépistage des patients atteints de cancer du poumon, augmentant ainsi le taux de survie à 5 ans des patients atteints de cancer du poumon et guidant le traitement clinique individualisé en temps opportun.
Les références:
1.Consensus d'experts chinois sur le diagnostic du cancer du poumon précoce (édition 2023)
2 J Cancer Res Clin Oncol. 2020 juin;146(6):1379-1393
3.Oncol avant. 2022 juin 28;12:849024.
4.Oncol avant. 14 décembre 2020;10:565780.