#Tendances produits
Nouvelles cibles thérapeutiques pour le cancer épithélial de l'ovaire
Le cancer de l'ovaire représente une menace importante pour la santé des femmes.
À l'échelle mondiale, elle se classe au huitième rang des tumeurs malignes les plus fréquentes chez les femmes et est la malignité gynécologique la plus mortelle, avec le taux de mortalité le plus élevé parmi les trois principales tumeurs gynécologiques (cancers de l'ovaire, du col de l'utérus et de l'endomètre) [1]. En Chine, la situation concernant la prévention et le traitement du cancer de l'ovaire est tout aussi sombre. Le cancer de l'ovaire se classe au troisième rang des trois principales tumeurs gynécologiques en termes d'incidence et augmente chaque année. Le taux de mortalité est également le plus élevé parmi les tumeurs malignes de l'appareil reproducteur féminin [2]. Le cancer de l'ovaire est souvent qualifié de « tueur silencieux » parce qu'il se situe profondément dans le bassin et que ses premiers symptômes sont souvent cachés. Au moment du diagnostic, 70 % des patients sont déjà à un stade avancé d'extension pelvienne et abdominale (stade III/IV) [3]. Parmi les différents types de cancer de l'ovaire, le carcinome épithélial est le plus fréquent, représentant environ 80 % des tumeurs malignes de l'ovaire [4]. Selon la classification de l'OMS de 2014, le cancer épithélial de l'ovaire peut être classé en carcinome séreux (70 à 80 %), carcinome endométrioïde (10 %), carcinome à cellules claires (10 %), carcinome mucineux (3 %) et autres types rares (<5%) [5].
Le carcinome séreux peut être divisé en carcinome séreux de haut grade (HGSC) et carcinome séreux de bas grade (LGSC). Le HGSC représente environ 70 % des cas de cancer épithélial de l'ovaire, tandis que le LGSC représente 5 % [5]. Le HGSC est le type le plus courant de cancer de l'ovaire et se caractérise par une forte invasion et un mauvais pronostic. Environ 70 % des patients présentent une récidive dans les trois ans après un traitement standard (chirurgie + chimiothérapie), et finalement, beaucoup sont incurables en raison d'une résistance acquise aux médicaments [6]. Ces dernières années, le pronostic de l'HGSC chez les patients porteurs de mutations BRCA1/2 s'est significativement amélioré avec l'utilisation des inhibiteurs de PARP. Avec l'élucidation continue des caractéristiques moléculaires du cancer de l'ovaire, le traitement s'est progressivement déplacé vers une thérapie de précision individualisée, et le développement et l'application de médicaments ciblés ont apporté un nouvel espoir et changé l'approche thérapeutique traditionnelle.
L'équipe de recherche du TCGA a analysé l'expression de l'ARNm, l'expression du microARN, la méthylation du promoteur, le nombre de copies d'ADN et le séquençage de l'ADN exonique des gènes codants dans 489 cas d'adénocarcinome ovarien séreux de haut grade. Ils ont constaté que presque toutes les patientes atteintes d'un cancer séreux de l'ovaire de haut grade présentaient des mutations TP53 (96 %), suivies de mutations BRCA1/2 (accumulées dans les mutations germinales et somatiques, représentant 22 % des cas) [7] (Figure 1). Après l'apparition de mutations TP53, la fonction de point de contrôle G1/S des cellules tumorales est perdue. La kinase WEE1 peut bloquer l'entrée des cellules en mitose au point de contrôle G2/M et réparer l'ADN endommagé pour maintenir la stabilité génomique [8] (Figure 2). Si le point de contrôle des cellules G2/M est soulagé à l'aide d'un inhibiteur de WEE1, les dommages à l'ADN des cellules tumorales ne peuvent pas être réparés, ce qui conduit à une « létalité synthétique » [8]. Par conséquent, les inhibiteurs de WEE1 sont devenus des médicaments thérapeutiques ciblés potentiels pour le cancer épithélial de l'ovaire muté par TP53. Actuellement, seul l'adavosertib (AZD1775/MK1775) est en essai clinique.
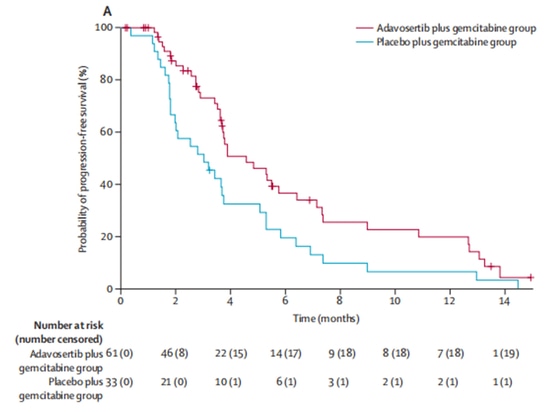
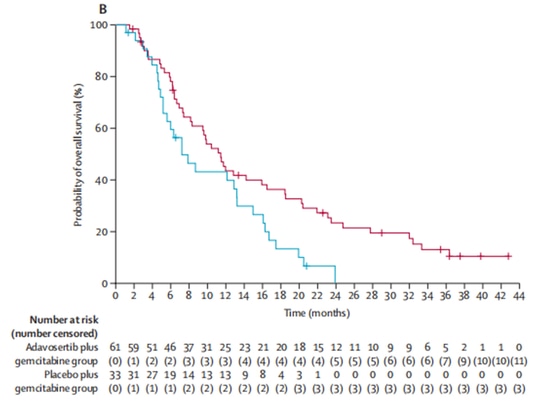
Récemment, les résultats d'un essai clinique de phase II (NCT02151292), publiés dans The Lancet, ont attiré l'attention mondiale. L'étude a inclus 99 patientes atteintes d'un cancer séreux de l'ovaire avancé, réfractaire et de haut grade (c'est-à-dire des patientes résistantes ou réfractaires à la chimiothérapie à base de platine).
Dans un rapport de 2:1, le groupe expérimental (n=65) a reçu le médicament expérimental adavosertib, inhibiteur de Wee1, en association avec un traitement à la gemcitabine, tandis que le groupe témoin (n=34) a reçu la gemcitabine seule. Après l'inscription, 5 patients ont abandonné l'essai clinique pour d'autres raisons et n'ont pas reçu de traitement. Sur les 94 patients restants ayant reçu un traitement, les taux de réponse objective étaient de 23 % dans le groupe expérimental et de 6 % dans le groupe témoin, ce qui indique une amélioration significative des taux de réponse objective avec l'adavosertib. En termes de survie, l'adavosertib a également prolongé de manière significative la survie médiane sans progression (mPFS) de 3,0 mois à 4,6 mois, avec une réduction de 45 % du risque de progression de la maladie. La médiane de survie globale (mOS) est passée de 7,2 mois à 11,4 mois, entraînant une prolongation moyenne de 4,2 mois [9] (Figure 3, Figure 4). L'étude démontre les avantages cliniques de l'inhibiteur de Wee1 en association avec la chimiothérapie.
De plus, un essai randomisé de phase II en double aveugle (NCT01357161) a démontré que l'adavosertib peut améliorer l'efficacité thérapeutique du cancer de l'ovaire sensible au platine avec mutation p53 lorsqu'il est associé à une chimiothérapie carboplatine/paclitaxel, améliorant la survie sans progression (SSP) (7,9 mois contre 7,3 mois). Il a été observé que l'adavosertib avait des bénéfices cliniques modérés [10]. Un autre essai clinique de phase II (NCT01164995) a indiqué que l'adavosertib améliore l'efficacité du carboplatine dans le cancer de l'ovaire mutant p53, avec un taux de réponse global de 43 %, mais une résistance finit par se développer [11]. Une étude clinique de phase II (NCT02272790) a montré les avantages cliniques de l'adavosertib en association avec un traitement au carboplatine ; cependant, ce traitement combiné a plus fréquemment provoqué une toxicité hématologique par rapport à la monothérapie au carboplatine [12]. Par conséquent, des recherches futures sont nécessaires pour optimiser la posologie et le schéma thérapeutique de l'association adavosertib et carboplatine.
Les inhibiteurs de PARP basés sur le principe de « létalité synthétique » ont démontré une efficacité significative dans le traitement du cancer de l'ovaire. De même, les inhibiteurs de WEE1 basés sur le même principe sont devenus une option intéressante pour le cancer épithélial de l'ovaire et ont montré une certaine efficacité dans d'autres tumeurs solides telles que le cancer de l'endomètre, le carcinome épidermoïde de la tête et du cou, le cancer du poumon à petites cellules et le cancer du pancréas. Le mécanisme de sensibilité aux inhibiteurs de WEE1 dans le cancer de l'ovaire est également étudié en permanence. La recherche a indiqué que l'état d'activation de mTOR affecte de manière significative la sensibilité des cellules cancéreuses à l'inhibition de WEE1. Il a également été rapporté que le cancer avec des défauts H3K36me3 est très sensible à l'inhibition de WEE1. Une équipe dirigée par Pan Chaoyun, Yao Shuzhong et Wang Wei de l'Université Sun Yat-sen en Chine a découvert que le gène ODF2L est un facteur clé déterminant la sensibilité des cellules tumorales épithéliales ovariennes à l'inhibition ciblée par WEE1. La combinaison du ciblage d'ODF2L et de WEE1 présente une létalité synthétique [13].
La protéine p53 mutante manque de poches appropriées pour la liaison du composé en raison de sa surface lisse, ce qui pose un défi important dans le développement de médicaments. Cette caractéristique a fait de TP53 l'une des trois cibles majeures « indroguables », aux côtés de RAS et MYC. Or, actuellement, il existe sur le marché deux médicaments ciblant le RAS, ce qui remet en cause la notion de son caractère « indroguable ». On espère que le prochain médicament basé sur le principe de la létalité synthétique pourra être approuvé et mis à disposition pour bénéficier à davantage de patients.
Les références:
[1] CA Cancer J Clin, 2021.
[2] Journal du Centre national du cancer, 2022, 2(1).
[3] NCCN Cancer de l'ovaire 2023 V1.
[4] Lignes directrices sur le diagnostic et le traitement du cancer de l'ovaire (édition 2022).
[5] Livre blanc sur le statut du diagnostic et du traitement du cancer de l'ovaire en Chine (édition 2022).
[6] Progrès dans l'application de la médecine de précision dans l'adénocarcinome séreux de haut grade de l'ovaire. Fudan Journal of Medical Sciences (édition médicale), 1-10.
[7] Nature, 2011, 474(7353) : 609-615.
[8] Cycle cellulaire, 2013, 12(19) : 3159-3164.
[9] Lancet, 23 janvier 2021 ; 397(10271): 281-292.
[10] Recherche clinique sur le cancer, 2020, 26(18) : 4767-4776.
[11] Journal of Clinical Oncology, 2016, 34(36): 4354-4361.
[12] Journal of Clinical Oncology, 2019, 37(15): S5513 [2021-10-24].
[13] Journal d'investigation clinique, 2023 ; 133(2) : e161544.