#Actualités du secteur
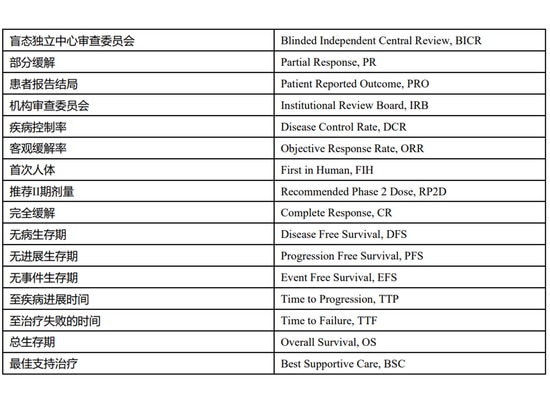
Interprétation des critères d'évaluation de l'efficacité de la recherche clinique des médicaments antinéoplasiques
Les paramètres d'efficacité les plus couramment utilisés dans les essais cliniques de médicaments antinéoplasiques comprennent la survie globale (OS), le taux de réponse objective (ORR), la survie sans progression (PFS) et le résultat rapporté par le
1. Survie globale (SG)
La survie globale a été définie comme le temps écoulé entre la randomisation (ou le début du traitement dans les essais à un seul bras) et le décès, quelle qu'en soit la cause. La SG est relativement objective et mesurable avec précision, et c'est le point final le plus fiable pour mesurer le bénéfice clinique des médicaments anticancéreux dans les essais cliniques contrôlés randomisés.
Avantages : Il s'agit de critères d'évaluation des avantages cliniques largement utilisés et reconnus, basés sur des critères objectifs et quantitatifs, précis et faciles à mesurer et à évaluer.
Inconvénients : la survie à 5 ans est souvent utilisée dans les essais cliniques, nécessitant souvent de grands échantillons et un suivi plus long. Les résultats de l'étude peuvent être affectés par le croisement et le traitement ultérieur, et l'inclusion des décès non tumoraux dans les résultats de l'étude affectera également l'exactitude des résultats.
2. Taux de réponse objective (ORR)
Pour de nombreux types de tumeurs, l'évaluation de la maladie peut être effectuée directement à l'aide de l'imagerie tumorale, et les stratégies de traitement pour les sujets sont souvent basées sur des mesures tumorales et des symptômes cliniques. Le taux de réponse objective fait référence à la proportion de patients dont le volume tumoral se réduit à une valeur prédéterminée et peut maintenir le délai minimum selon les critères d'évaluation de réponse reconnus (tels que Solid Tumors RECIST version 1.1). C'est le critère d'évaluation le plus courant basé sur la mesure de la tumeur. La réponse des tumeurs solides peut être une réponse complète (CR) ou une réponse partielle (PR), et il existe d'autres critères d'évaluation pour l'évaluation des tumeurs non solides. L'utilisation de l'ORR seul peut ne pas être en mesure de décrire de manière adéquate l'activité antitumorale du médicament expérimental [2], il est donc nécessaire d'analyser de manière descriptive la durée de la réponse (c'est-à-dire le temps écoulé entre la réponse tumorale initiale et la progression de la maladie ou le décès quelle qu'en soit la cause , selon la première éventualité) et le délai de rémission. Pour les médicaments qui bénéficient cliniquement aux patients en stabilisant l'état de la maladie, le taux de contrôle de la maladie (DCR) peut également être analysé. Cet indicateur considère non seulement les cas de rémission de la maladie, mais comprend également les cas dans lesquels la maladie maintient un état stable pendant une certaine période de temps.
Avantages : Cela nécessite généralement une taille d'échantillon plus petite et un temps de suivi plus court. L'effet curatif est attribué au médicament et l'exclusion de l'évolution naturelle de la maladie est généralement basée sur une évaluation objective et quantitative, ce qui convient mieux aux essais d'enrichissement de la population.
Inconvénients : le plus grand inconvénient de l'ORR est que l'efficacité de l'ORR peut ne pas être convertie en avantages de survie, et des évaluations d'imagerie fréquentes sont nécessaires lors de l'évaluation de l'ORR, et l'ORR n'est pas une mesure directe du bénéfice clinique des médicaments. De plus, l'utilisation de l'ORR seul peut ne pas décrire complètement l'activité antitumorale du médicament expérimental, il est donc nécessaire d'analyser de manière descriptive la durée de la réponse (c'est-à-dire le temps écoulé entre la rémission initiale de la tumeur et la progression de la maladie ou le décès quelle qu'en soit la cause, selon la première éventualité ) et au temps de réponse.
3. Survie sans progression (PFS)
La survie sans progression a été définie comme le temps écoulé entre la randomisation (ou le début du traitement dans les essais à un seul bras) et la progression tumorale ou le décès quelle qu'en soit la cause, selon la première éventualité. Les critères d'évaluation similaires à la SSP incluent également la survie sans maladie (DFS), qui fait référence au temps écoulé entre le début de la randomisation (ou le début du traitement dans un essai à un seul bras) et la récidive de la maladie ou le décès de toute cause (selon la première éventualité) standard ), et est principalement utilisé pour évaluer un traitement adjuvant après un traitement chirurgical ou une radiothérapie. La survie sans événement (EFS) est définie comme le temps écoulé entre le début de la randomisation (ou le début du traitement dans un essai à un seul bras) et la première survenue de l'un des événements suivants : progression de la maladie au-delà de la chirurgie, récidive locale ou à distance, La cause du décès, etc., est surtout utilisée pour évaluer le traitement néoadjuvant avant un traitement chirurgical ou une radiothérapie.
Avantages : Il nécessite généralement une taille d'échantillon plus petite et un suivi plus court par rapport à l'OS. Les études sont généralement basées sur des évaluations objectives et quantitatives, qui ne sont pas affectées par le croisement et le traitement ultérieur, et ont une plus grande fiabilité.
Inconvénients : la SSP est fortement corrélée à la SG, mais là encore, elle peut ne pas se traduire par un avantage en termes de survie. L'évaluation de la SSP nécessite des évaluations d'imagerie fréquentes, avec un biais d'évaluation possible. Plus important encore, les résultats de la SSP seront affectés par l'intervalle d'évaluation, et la définition et les règles de censure de la SSP peuvent également être différentes entre les différents essais, elles doivent donc être clairement définies à l'avance.
4. Résultat rapporté par le patient (PRO)
Les résultats rapportés par les patients sont des rapports provenant directement des patients concernant leurs symptômes, leur qualité de vie liée à la santé, l'observance du traitement et leur satisfaction à l'égard du traitement. Bien qu'il soit de plus en plus courant de collecter des données PRO dans les essais cliniques de médicaments anticancéreux, de nombreux problèmes subsistent dans l'évaluation de tels indicateurs de mesure, tels que la fiabilité, la validité et la réactivité des échelles utilisées. En outre, les indicateurs de mesure PRO [3] sont également susceptibles de manquer de données, et des méthodes appropriées doivent être utilisées pour traiter les données manquantes. Pour mieux comprendre la pertinence des résultats des essais, il est recommandé d'explorer le PRO par rapport à d'autres paramètres d'efficacité.
Les références
[1] "Lignes directrices pour la conception statistique des essais cliniques de médicaments antinéoplasiques (essai)" édition 2020
[2] Recherche clinique sur le cancer, 2005, 11(21) : 7872-7878.
[3]ICH. E9 (R1) Addenda sur les estimations et l'analyse de sensibilité dans les essais cliniques à la ligne directrice sur les principes statistiques pour les essais cliniques. 2019