#Tendances produits
Avancées de la recherche liées à la cible CLDN18.2
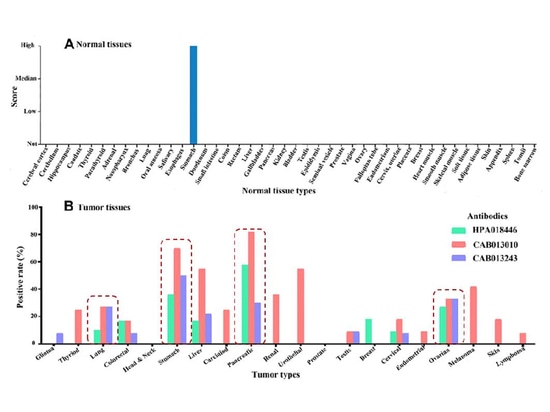
Contexte - Protéine Claudin18.2
La famille des protéines CLDN comprend au moins 27 protéines transmembranaires, qui peuvent être classées en deux types : classiques et non classiques, en fonction de leur séquence. CLDN18 appartient au type non classique. La protéine exprimée par CLDN18 subit des modifications d'épissage, résultant en deux sous-types : CLDN18.1 et CLDN18.2. CLDN18.2 est une protéine marqueur hautement sélective qui est principalement exprimée dans les cellules épithéliales différenciées de la muqueuse gastrique dans les tissus normaux. Cependant, en cas de malignité tissulaire, CLDN18.2 montre une expression correspondante, en particulier dans les tumeurs du tube digestif telles que le cancer gastrique, le cancer du pancréas, le cancer de l'œsophage, le cancer des voies biliaires et le cancer de la vésicule biliaire. La présence de CLDN18.2 a également été détectée dans les tissus du cancer de l'ovaire et du cancer du poumon [1-4].
Selon les statistiques, environ 33 % à 37 % des patients atteints de tumeurs solides présentent une expression élevée de CLDN18.2. De plus, une étude a montré que parmi les patients atteints d'un cancer gastrique, environ 16 % à 73 % des individus étaient positifs pour l'expression de CLDN18.2 [5].
CLDN18.2 et cancer gastrique
Actuellement, il existe une variation significative des taux de positivité rapportés de la protéine Claudin18.2 chez les patients atteints de cancer gastrique, ce qui pourrait être attribué à des différences d'origine ethnique, de réactifs et de critères de détection. Rohde et al. [6], utilisant le test CLAUDETECT™18.2 avec les mêmes critères de positivité, ont trouvé un taux d'expression positive de 52 % chez des patients japonais atteints d'un cancer gastrique. Dottermusch et al. [7], utilisant un anticorps anti-Claudin18.2 d'ABCAM pour détecter une population caucasienne, a utilisé un système de notation tissulaire comme critère d'expression positive et a rapporté un taux de positivité de 42,2 % dans les cas de cancer gastrique. Baek et al. [8], dans une population coréenne utilisant l'anticorps ABCAM anti-Claudin18.2, ont utilisé une méthode de notation semi-quantitative avec un score de 3 (51 % à 100 % de coloration) comme critère d'expression positive, et selon cette norme , 29,4 % des patients ont montré une expression positive. Xu et al. [9], dans leur étude de 105 échantillons pathologiques de patients atteints de carcinome gastrique avancé à chevalières, ont mis en évidence un taux d'expression positive de Claudin18.2 de 95,2 % (100/105), significativement supérieur à celui des patients ordinaires atteints d'adénocarcinome gastrique. Parmi les échantillons, 64,8 % (68/105) ont montré des niveaux d'expression modérés à élevés de Claudin18.2, et dans 21,0 % (22/105) des échantillons, le niveau d'expression de Claudin18.2 était même ≥ 90 %. Les études ci-dessus suggèrent un taux d'expression positif élevé de Claudin18.2 chez les patients atteints de cancer gastrique, et le taux d'expression et l'intensité sont positivement corrélés à la malignité. CLDN18.2 est applicable au traitement de nombreux patients atteints d'adénocarcinome gastrique.
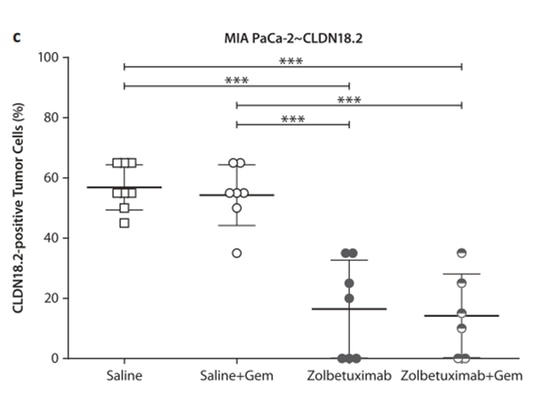
CLDN18.2 et cancer du pancréas
En plus de son expression élevée et stable dans divers tissus cancéreux gastriques, CLDN18.2 est également exprimé de manière aberrante dans les tissus cancéreux du pancréas [11]. Kojima et al. [12] ont découvert que CLDN18 peut réguler de manière transcriptionnelle les molécules de jonction serrées dans les cellules épithéliales canalaires pancréatiques humaines normales via la voie de signalisation de la protéine kinase C. Dans les tissus cancéreux du pancréas, CLDN18.2 peut être induit par des activateurs PKC et des modifications de la méthylation de l'ADN. Des études ont montré [13] que la gemcitabine (GEM) peut réguler à la hausse l'expression de CLDN18.2 dans les cellules cancéreuses du pancréas, améliorant la cytotoxicité cellulaire dépendante des anticorps induite par le zolbetuximab (ADCC). Pour les types de cancer du pancréas résistants à la gemcitabine, le zolbetuximab peut ralentir la croissance tumorale et réduire les métastases, prolongeant ainsi la survie. Cela soutient davantage l'utilisation potentielle du zolbetuximab en monothérapie ou en association avec la gemcitabine pour les patients atteints d'un cancer du pancréas exprimant CLDN18.2.
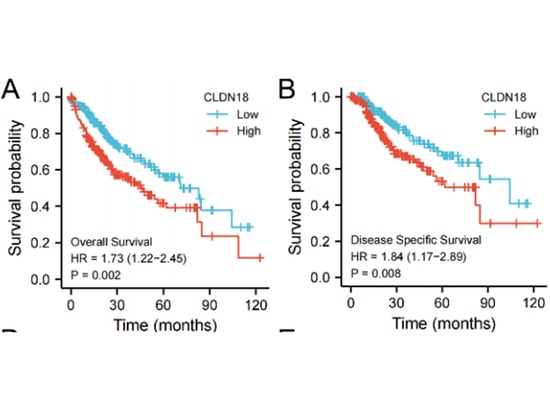
CLDN18 et carcinome hépatocellulaire
La recherche a montré [14] que par rapport aux cellules ou tissus normaux, CLDN18 est fortement exprimé dans le carcinome hépatocellulaire (CHC) et est associé à un mauvais pronostic de survie, servant de facteur de risque pour la progression du CHC. CLDN18 présente diverses fonctions liées à la tumeur et participe à plusieurs voies de signalisation liées à la tumeur. Sa forte expression est significativement corrélée à plusieurs indicateurs pathologiques cliniques de la progression du CHC et peut favoriser l'infiltration des cellules immunitaires. La construction de modèles de diagnostic et de pronostic du CHC basés sur CLDN18 montre une valeur prédictive prometteuse. En résumé, le CLDN18 peut favoriser la progression du CHC et indiquer un mauvais pronostic clinique.
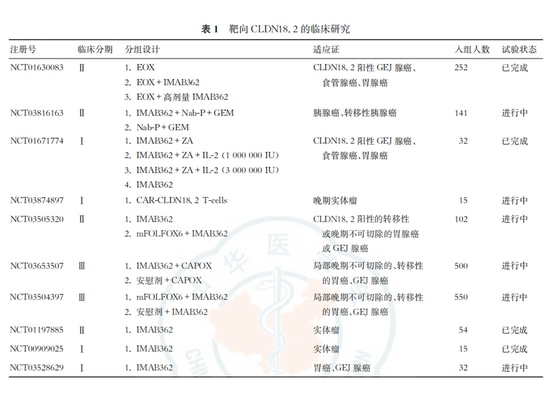
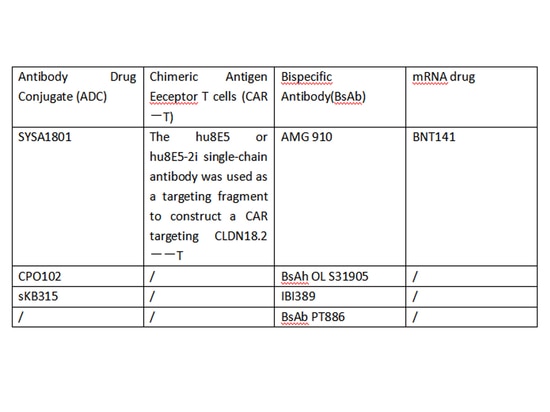
Recherche sur d'autres médicaments ciblés
Claudin18.2, en tant que cible pan-cancer, présente une expression anormale dans diverses tumeurs épithéliales et est devenue l'une des cibles les plus recherchées dans la recherche sur le cancer. Les recherches actuelles sur le ciblage de Claudin18.2 englobent presque toutes les approches courantes, y compris les anticorps monoclonaux, les anticorps bispécifiques, les cellules CAR-T et les conjugués anticorps-médicament (ADC). Il y a de grandes attentes pour Claudin18.2, et il a le potentiel de devenir le prochain "PD-1".
L'osemitamab est un anticorps de deuxième génération ciblant Claudin18.2 actuellement en cours de développement dans le monde entier. Il s'agit d'un anticorps monoclonal humanisé hautement optimisé en affinité contre Claudin18.2. L'osemitamab est conçu pour présenter une cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC) et une cytotoxicité dépendante du complément (CDC) améliorées.
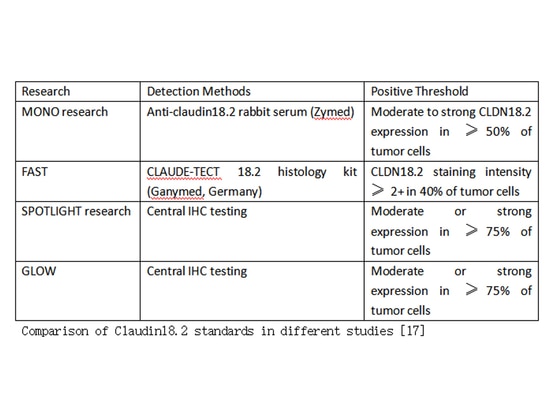
Méthodes de détection
Actuellement, la principale méthode de détection de l'expression protéique de CLDN18.2 est l'immunohistochimie (IHC). Il existe deux sources principales d'anticorps de détection bien établis : CLAUDETECT (Ganymed, Allemagne) utilisé dans l'étude FAST et Abcam (Cambridge, USA). L'anticorps CLAUDETECT a un taux de détection positive légèrement supérieur à celui des anticorps d'Abcam. Il convient de noter que différentes études peuvent avoir des seuils différents pour déterminer la positivité pour Claudin18.2.
Actuellement, les méthodes de détection utilisées dans les études cliniques pour Claudin18.2 sont principalement basées sur l'immunohistochimie (IHC). Cependant, il existe différents critères pour définir le seuil positif en recherche clinique et il n'existe actuellement aucune norme unifiée. En Chine, la plupart des produits enregistrés pour la détection de Claudin18.2 utilisent la méthodologie d'immunohistochimie.
Résumé
Claudin18.2 est largement distribué à la surface de diverses cellules cancéreuses et représente une solution potentielle. La combinaison de son ciblage avec d'autres cibles thérapeutiques peut offrir des avantages supplémentaires pour un plus large éventail de patients.
Référence:
[1] Antican—cer Res, 2019, 39(12):6973—6979.
[2] The AdV Med 0ncol, 2022, 14 : 17588359221083049.
[3] Clin Cancer Res, 2008, 14(23): 7624—7634.
[4] Hi-stol Histopathol, 2022, 37(10): 1031-1040.
[5] Cancers (Bâle). 18 mars 2020;12(3):711.
[6] Jap J Clin Oncol, 2019, 49(9): 870-876.
[7] Virchows Arch, 2019, 475 : 563-571.
[8] Recherche anticancéreuse, 2019, 39 (12) : 6973-6979.
[9] Gastrointest Oncol, 2020, 11(6) : 1431-1439.
[10] Progrès de la recherche sur la protéine transmembranaire CLDN18.2 dans la thérapie ciblée contre le cancer
[11] Hi-stol Histopathol, 2022, 37(10): 1031-1040
[12] Ann N Y Acad Sci, 2012, 1257 : 85—92
[13] Oncoimmunologie. 10 novembre 2018;8(1):e1523096.
[14] Le rôle biologique de CLDN18 dans la progression du carcinome hépatocellulaire et sa valeur pronostique
[15] Biomark Res. 31 mai 2022;10(1):38.
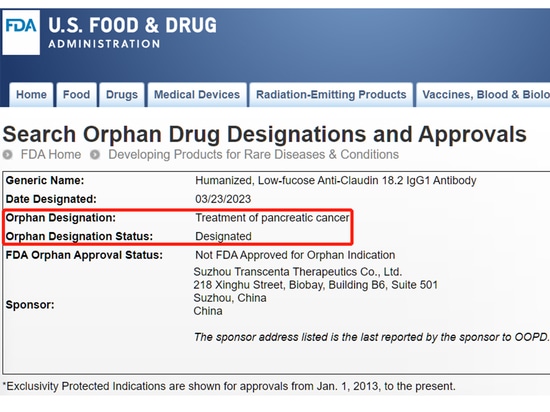
[16] Site Web de la FDA
[17] Progrès de la recherche de CLDN18.2 dans le cancer gastrique
Clause de non-responsabilité : ce texte est fourni à des fins de partage uniquement et ne représente pas la position de la plateforme. S'il y a des droits d'auteur ou d'autres problèmes, veuillez nous contacter rapidement et nous apporterons des corrections dès que possible. Merci!