#Tendances produits
Une des cibles brûlantes de la thérapie pan-cancer - FGFR
La famille des FGFR (Fibroblast Growth Factor Receptor) comprend principalement quatre sous-types : FGFR1, FGFR2, FGFR3 et FGFR4.
Arrière-plan:
La famille des FGFR (Fibroblast Growth Factor Receptor) comprend principalement quatre sous-types : FGFR1, FGFR2, FGFR3 et FGFR4. Chaque sous-type possède un motif structurel constitué d'un extrLa famille FGFR (Fibroblast Growth Factor Receptor) comprend principalement quatre sous-types : FGFR1, FGFR2, FGFR3 et FGFR4. Chaque sous-type possède un domaine conacellulaire à motif structurel pour la liaison au ligand, un domaine transmembranaire et un domaine intracellulaire pour la phosphorylation des récepteurs. Ces récepteurs font partie de la voie de signalisation de la tyrosine kinase responsable de la prolifération et de la différenciation cellulaire. Les altérations moléculaires du FGFR peuvent conduire à une signalisation FGF/FGFR aberrante, favorisant la prolifération cellulaire, l'angiogenèse, l'invasion, les métastases et l'anti-apoptose, qui sont associées à un large éventail de tumeurs malignes humaines. La fusion et la dérégulation du FGFR sont étroitement liées à la survenue et au développement de divers cancers. Actuellement, des variations du gène FGFR ont été signalées dans plus de dix tumeurs malignes, notamment le cholangiocarcinome, le carcinome urothélial (20%), le cancer du sein, le cancer du poumon, le carcinome hépatocellulaire et diverses tumeurs solides.
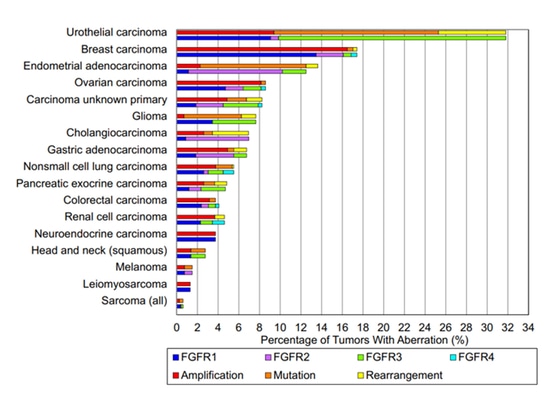
En janvier 2016, un article publié dans Clinical Cancer Research a utilisé la technologie de séquençage de nouvelle génération pour détecter les mutations du FGFR dans 4 853 échantillons de patients atteints de divers cancers, y compris les amplifications, les mutations et les réarrangements. Parmi les échantillons séquencés, l'étude a observé un taux d'incidence global des mutations du FGFR à 7,1 %, les réarrangements géniques étant les moins répandus à 8 % [1].
Dans différents types de cancer
Jusqu'à présent, les inhibiteurs du FGFR peuvent être classés en trois types principaux : les inhibiteurs de la tyrosine kinase (TKI), les anticorps monoclonaux (mAb) et les pièges à ligands du FGF [2].
1. Inhibiteurs de la tyrosine kinase (ITK) :
Les TKI peuvent être classés en inhibiteurs multi-cibles du FGFR et en inhibiteurs sélectifs du FGFR. Les TKI FGFR sélectifs sont divisés en trois classes :
un. Inhibiteurs pan-FGFR : ces inhibiteurs ciblent efficacement FGFR1 à FGFR4 simultanément.
b. Inhibiteurs de FGFR1-3 : Ces inhibiteurs ciblent efficacement FGFR1 à FGFR3 mais ont de faibles effets inhibiteurs sur FGFR4.
c. Inhibiteurs de FGFR4 : Ces inhibiteurs ont une sélectivité plus faible contre FGFR1 à FGFR3.
L'erdafitinib a été le premier inhibiteur du FGFR approuvé dans le monde et a été approuvé par la FDA américaine en 2019 pour le traitement du carcinome urothélial. Les résultats de l'essai clinique de phase II BLC2001 (NCT02365597) ont montré des résultats prometteurs chez 99 patients atteints de carcinome urothélial hébergeant des altérations FGFR2/FGFR3. Le taux de réponse globale (ORR) était de 40 % (réponse complète [RC] 3 %, réponse partielle [RP] 37 %), avec une survie sans progression (SSP) médiane de 5,5 mois et une survie globale (SG) médiane de 13,8 mois. Ces résultats positifs ont permis à l'Erdafitinib de devenir le premier inhibiteur sélectif oral du FGFR approuvé par la FDA.
Après l'Erdafitinib, le pemigatinib et l'infigratinib ont ensuite été approuvés pour le traitement du cholangiocarcinome, alimentant davantage l'intérêt de la recherche pour les ITK FGFR. Comme le FGFR est exprimé dans divers types de cancer, une exploration continue des TKI du FGFR dans différents types de cancer est en cours.
Le développement d'inhibiteurs de FGFR représente une avancée significative dans les thérapies ciblées contre le cancer, offrant des options de traitement potentielles pour les patients atteints de cancers altérés par le FGFR. Alors que la recherche dans ce domaine se poursuit, l'espoir est que les inhibiteurs de FGFR amélioreront encore les résultats et étendront leurs applications à plusieurs types de cancer.
Exploration dans le cancer gastrique
Dans le contexte de l'oncologie de précision, diverses nouvelles voies moléculaires potentielles servent de nouvelles cibles pour le développement de médicaments dans le cancer gastrique. L'une de ces cibles est le récepteur du facteur de croissance des fibroblastes (FGFR). La figure ci-dessous montre la distribution anatomique et l'incidence relative des sous-types de l'Atlas du génome du cancer (TCGA) dans tout l'estomac. Le tableau fournit différentes caractéristiques moléculaires et cliniques pour chacun des quatre sous-types.
Caractéristiques moléculaires et cliniques des sous-types TCGA du cancer de la jonction gastro-œsophagienne/gastro-œsophagienne (G/GEJ)[3]
Une étude de phase IIa multicentrique, ouverte et à un seul bras (NCT05019704) a étudié l'efficacité et l'innocuité de l'infigratinib chez des patients atteints de tumeurs solides avancées qui avaient déjà reçu au moins deux lignes de traitement systémique et hébergeaient une amplification du gène FGFR2. L'étude a inclus des patients atteints d'un cancer gastrique localement avancé ou métastatique ou d'un adénocarcinome de la jonction gastro-œsophagienne (GEJ) avec amplification du gène FGFR2, ainsi que d'autres tumeurs solides avancées avec d'autres altérations du gène FGFR.
Les résultats de l'étude ont démontré que parmi les patients précédemment traités atteints d'un cancer gastrique localement avancé ou métastatique ou d'un adénocarcinome GEJ, et porteurs d'une amplification du gène FGFR2, le taux de réponse objective (ORR) était de 25,0 % (n = 20) et la durée médiane de réponse (DOR) était de 3,8 mois [4].
Ces résultats indiquent que l'infigratinib a montré un certain niveau d'efficacité dans ce groupe spécifique de patients atteints de cancers avancés de la jonction gastrique et gastro-œsophagienne qui avaient une amplification du gène FGFR2. Cependant, il est important de noter qu'il s'agissait d'une étude à un seul bras et que d'autres investigations, y compris des essais contrôlés randomisés, sont nécessaires pour confirmer l'efficacité et l'innocuité du médicament dans une population plus large de patients présentant des altérations génétiques similaires.
Exploration dans les tumeurs hématologiques :
Le 26 août 2022, la Food and Drug Administration (FDA) des États-Unis a approuvé Pemazyre (pemigatinib) pour le traitement des patients adultes atteints de néoplasmes myéloïdes et lymphoïdes (MLN) récidivants ou réfractaires hébergeant des réarrangements du gène FGFR1, sur la base des données du FIGHT-203 procès. L'étude a inclus 28 patients avec des MLN en rechute ou réfractaires avec des réarrangements du FGFR1. Parmi les 18 patients en phase myéloïde chronique avec ou sans maladie extramédullaire (EMD), 14 ont obtenu une rémission complète (RC) (78 %), avec un délai médian jusqu'à la RC de 104 jours. Parmi les quatre patients avec ou sans EMD dans la moelle osseuse, deux ont obtenu une RC, et parmi les trois patients avec EMD, un a obtenu une RC. Le taux global de réponse cytogénétique complète était de 79 %, dont trois patients sans évidence morphologique [5].
Exploration en Pan-Cancer :
Lors de la réunion annuelle 2023 de l'AACR (American Association for Cancer Research), les données de l'essai de phase II FIGHT-207 ont été présentées, indiquant que le Pemazyre a démontré une efficacité et une bonne tolérance chez les patients lourdement traités atteints de tumeurs solides avancées/métastatiques ou non résécables hébergeant des mutations du FGFR ou fusions/réarrangements, y compris le cholangiocarcinome, les tumeurs du système nerveux central (SNC), les tumeurs gynécologiques et le cancer du pancréas. Les résultats de l'étude ont montré que le taux de réponse objective (ORR) pour les patients présentant des fusions ou des réarrangements de FGFR (n = 49 ; Cohorte A) était de 26,5 % (IC à 95 %, 15,0 % à 41,1 %), et le taux de contrôle de la maladie (DCR) était de 65,3 % (IC à 95 %, 50,4 %-78,3 %). Pour les patients porteurs de variants à un seul nucléotide (SNV) actionnables du FGFR (n=32 ; Cohorte B), l'ORR était de 9,4 % (IC à 95 %, 2,0 % à 25,0 %), et le DCR était de 56,3 % (IC à 95 %, 37,7 % -73,6%). Pour les patients présentant des mutations du domaine kinase FGFR ou des mutations de signification incertaine (n = 26 ; cohorte C), l'ORR était de 3,8 % (IC à 95 %, 0,1 % à 19,6 %), et le DCR était de 34,6 % (IC à 95 %, 17,2 %-55,7 %) [6]. Ainsi, Pemazyre a démontré une large activité antitumorale sur divers types de cancer.
Résumé:
Le FGFR s'est avéré être impliqué dans divers processus de développement du cancer, ce qui en fait une cible prometteuse pour l'approche de traitement "pan-cancer". Actuellement, les inhibiteurs multi-cibles du FGFR et trois inhibiteurs sélectifs du FGFR (Erdafitinib, Pemigatinib et Infigratinib) ont reçu l'approbation de la FDA, ce qui est susceptible de conduire à l'utilisation d'autres inhibiteurs sélectifs du FGFR en milieu clinique.
L'application clinique des inhibiteurs du FGFR fait face à trois défis principaux : l'émergence de la résistance acquise, la sélection des patients et les effets indésirables systémiques. Pour lutter contre la résistance acquise, des inhibiteurs covalents, des anticorps monoclonaux anti-FGFR et des pièges à ligands FGF sont en cours de développement, ce qui peut également réduire les effets indésirables systémiques. La thérapie combinée et le développement de composés uniques à double cible sont également des solutions potentielles pour la résistance acquise [2].
La médecine de précision est actuellement un axe majeur dans le traitement du cancer, et la sélection des patients joue un rôle essentiel dans le traitement du cancer. Le séquençage de nouvelle génération (NGS) peut aider à détecter des défauts moléculaires spécifiques dans le diagnostic et la progression de la maladie et à présélectionner les populations de patients pour les essais cliniques. Par conséquent, l'identification des biomarqueurs appropriés chez les patients afin de sélectionner l'inhibiteur de FGFR le plus approprié pour une efficacité optimale est cruciale.
Les références:
1. Clin Cancer Res. 1 janvier 2016;22(1):259-67
2. Progrès dans la thérapie ciblée pour le FGFR dans le cancer
3. Nat Rev Clin Oncol 2021 août;18(8):473-487
4. Identifiant ClinicalTrials.gov : NCT05019794
5. Site Web officiel de la FDA
6. Assemblée annuelle 2023 de l'AACR ; 14-19 avril 2023 ; Orlando, Floride. Résumé CT016
Clause de non-responsabilité : ce texte est fourni à des fins de partage uniquement et ne représente pas la position de la plateforme. S'il y a des droits d'auteur ou d'autres problèmes, veuillez nous contacter rapidement et nous le corrigerons dès que possible. Merci!