#Tendances produits
Les biomarqueurs des sous-types du cancer de l'endomètre
Le sous-typage moléculaire du cancer de l'endomètre (CE) est devenu un sujet brûlant dans le domaine de l'oncologie gynécologique au cours des deux dernières années.
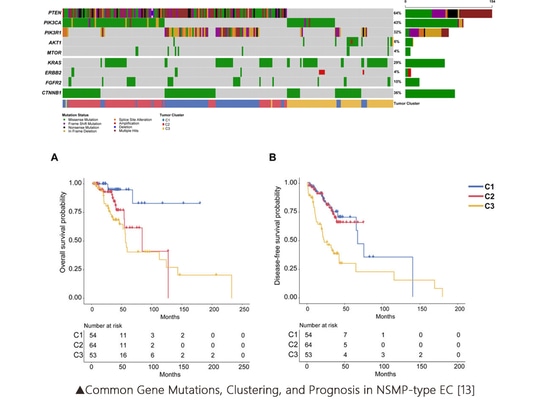
La classification de la CE a évolué d'une simple classification histologique à une classification génétique moléculaire. Grâce au séquençage à haut débit (NGS) et à d’autres méthodes de détection, la CE a été classée en quatre sous-types moléculaires présentant des différences significatives. Les marqueurs essentiels pour cette classification comprennent POLE, MMR/MSI et TP53/p53. Dans l'étude Cancer Genome Atlas (TCGA), outre les marqueurs de sous-types susmentionnés, il existe également de nombreux gènes fréquemment mutés, tels que PTEN, KRAS, PIK3CA, CTNNB1, etc. À mesure que la recherche progresse, les rôles de ces marqueurs de sous-types supplémentaires sont continuellement dévoilé.
Caractéristiques du sous-type moléculaire TCGA [1-2]
En plus du sous-typage supplémentaire, 67 à 91 % des patients atteints de CE présentent au moins une mutation génétique qui pourrait potentiellement servir de cible aux médicaments approuvés par la FDA ou aux médicaments en cours d'essais cliniques. Actuellement, plusieurs études cliniques pan-cancer étudient l'efficacité des thérapies ciblées sur des gènes tels que PI3K/AKT/mTOR, KRAS, AKT1, FGFR2, FBXW7 et PTEN[3].
01 CTNNB1
CTNNB1 est probablement l’un des gènes de sous-types supplémentaires les plus étudiés. Ce gène code pour la bêta-caténine, qui joue un rôle dans la régulation de l'adhésion cellulaire et de la signalisation cellulaire[4]. La fréquence de mutation du gène CTNNB1 dans le sous-type CN-L est de 52 %[1]. Certaines premières études ont montré que chez les patients atteints de CE aux stades G1/2 et I/II, malgré de faibles taux d'invasion de l'espace lymphovasculaire (LVSI) et d'infiltration musculaire, des mutations pathogènes sur l'exon 3 du gène CTNNB1 étaient associées à une survie sans récidive plus faible ( RFS) avec un rapport de risque (HR) de 5,97. Les tumeurs présentant des mutations CTNNB1 présentaient également une probabilité considérablement réduite de mutations dans KRAS, TP53 et FGFR2 [5].
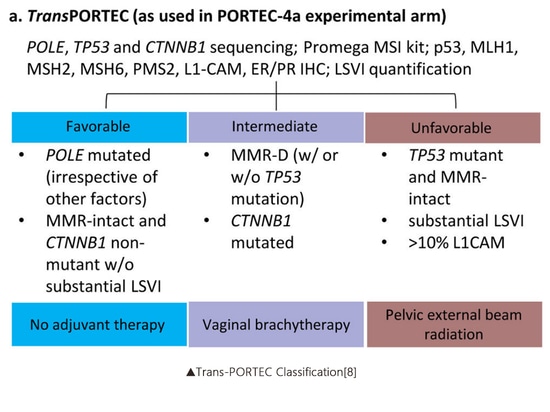
En 2016, Stelloo et al., s'appuyant sur la classification ProMisE, ont combiné les mutations de l'exon 3 CTNNB1, une expression élevée de L1CAM (> 10 %) et LVSI pour proposer davantage la classification Trans-PORTEC (favorable, intermédiaire et défavorable). Cette classification visait à fournir une stratification du risque plus précise pour le sous-type de cancer de l'endomètre le plus vaste et le plus hétérogène, connu sous le nom de type à profil moléculaire non spécifique (NSMP). Il a été constaté que le pronostic était pire pour le sous-type de mutation de l'exon 3 CTNNB1 par rapport au sous-type de type sauvage [6]. L'essai PORTEC-4a (NCT03469674) est la première étude clinique au monde qui détermine des stratégies de traitement adjuvant basées sur le sous-typage moléculaire. L'étude vise à comparer l'efficacité du traitement adjuvant sur la base d'une analyse complète des risques du sous-typage moléculaire avec la curiethérapie vaginale standard pour le cancer de l'endomètre. La méthode de stratification utilisée est la classification Trans-PORTEC susmentionnée[7].
▲Classification Trans-PORTEC[8]
En plus du sous-typage auxiliaire, les mutations du gène CTNNB1 peuvent également fournir des indications sur l'efficacité du traitement. Une étude de phase II (NCT01068249) a démontré que les patients atteints de CE porteurs de mutations CTNNB1 peuvent bénéficier de l'association d'évérolimus et de létrozole[9]. Cette approche thérapeutique est également une option privilégiée pour l'hormonothérapie dans la CE récurrente ou métastatique, selon les directives du National Comprehensive Cancer Network (NCCN) [10].
Concernant les méthodes de détection des mutations de CTNNB1, alors que l’immunohistochimie (IHC) pour l’expression de la bêta-caténine nucléaire pourrait servir d’alternative pour détecter les mutations de l’exon 3 de CTNNB1, les tests NGS restent la référence[4].
02 PTEN
PTEN est un gène suppresseur de tumeur. La protéine PTEN possède à la fois des activités protéine phosphatase et lipide phosphatase, participant à la régulation du cycle cellulaire, de la prolifération et de la réparation de l'ADN en inhibant la voie de signalisation PI3K/AKT. De plus, la perte de PTEN altère la fonction de la protéine CHK1, conduisant à l’accumulation de cassures double brin de l’ADN et à une instabilité génomique. Il régule également l'expression de RAD51, qui est une protéine clé dans la réparation par recombinaison homologue (HR)[11].
▲Fonctions principales du PTEN [12]
Les mutations du gène PTEN sont les mutations somatiques les plus courantes dans le carcinome de l'endomètre endométrioïde (CEE), représentant des événements précoces mais non entièrement établis dans la tumorigenèse [8]. Des fréquences de mutation élevées sont observées dans le sous-type hypermuté POLE, le sous-type MSI-H à mutation élevée et le sous-type CN-L, avec des taux de 94 %, 89 % et 77 % respectivement. Dans le sous-type CN-H, la fréquence de mutation du PTEN n'est que de 11 à 15 % et les mutations du gène PTEN sont rares dans le carcinome séreux (2 %)[1]. Dans la CEE, les mutations PTEN coexistent souvent avec les mutations PIK3CA et PIK3R1, et la perte de PTEN présente également des effets synergiques avec les mutations CTNNB1 ou l'inactivation de MLH1 [7]. Dans la plupart des cas de CEE, les mutations PTEN et TP53 s’excluent souvent mutuellement. Cependant, environ 50 % des cas de CEE de haut grade avec des mutations TP53 ont des mutations PTEN coexistantes, où les mutations TP53 et PTEN sont non silencieuses[1].