Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Tendances produits
La relation entre le cancer de la thyroïde et le gène BRAF
La relation entre le cancer de la thyroïde et le gène BRAF
Ces dernières années, l'incidence du cancer de la thyroïde a continué à augmenter rapidement dans de nombreux pays et régions du monde. Près de 600 000 nouveaux cas sont recensés chaque année dans le monde et les patients chinois représentent plus d'un tiers d'entre eux (figure 1). Le ratio femmes/hommes est d'environ 3:1 [1].
Figure 1 Les dix cancers les plus fréquents en Chine en 2020
Le cancer de la thyroïde est la tumeur endocrinienne maligne la plus fréquente et provient des cellules épithéliales folliculaires ou parafolliculaires de la thyroïde (figure 2). En fonction de l'origine et de la différenciation de la tumeur, le cancer de la thyroïde peut être divisé en cancer différencié de la thyroïde (CDT), cancer médullaire de la thyroïde (CMT), cancer peu différencié de la thyroïde (CPT) et cancer anaplasique de la thyroïde (CAT). Le cancer de la thyroïde peu différencié est subdivisé en cancer papillaire de la thyroïde (CPT) et en cancer folliculaire de la thyroïde (CFT) [2]. Parmi tous les types de tissus, le CTP est le plus fréquent, représentant environ 90 % de tous les cancers de la thyroïde. Des études ont montré que le gène muté le plus courant dans le CPT est BRAF, avec un taux de mutation allant jusqu'à 80 %, alors que les mutations sont moins fréquentes dans le CTA et qu'elles sont rares dans les nodules bénins, le CFT, le CMT et le CPT [3]. Depuis la découverte initiale des mutations du gène BRAF dans les cancers humains, plus de 40 sites de mutation ont été identifiés, parmi lesquels le site T1799A est la mutation BRAF la plus courante, représentant plus de 90 % de toutes les mutations du gène BRAF. Le site T1799A est situé sur l'exon 15 du gène BRAF. La mutation sur ce site entraîne le remplacement de la valine (V) en position 600 dans le produit protéique par l'acide glutamique (E) (appelé V600E), activant ainsi la kinase BRAF et provoquant la cancérogénèse [4]. La mutation BRAF V600E est étroitement liée à la CTP et constitue un marqueur tumoral très important pour la CTP. Le risque de nodules thyroïdiens malins avec mutation BRAF atteint 99,8 % [3]. Parallèlement, les mutations BRAF sont étroitement liées à la progression clinique, à la récurrence et à la résistance à l'iode de la CPT.
Figure 2 Thyroïde
Mutation BRAF et progression clinique du cancer de la prostate
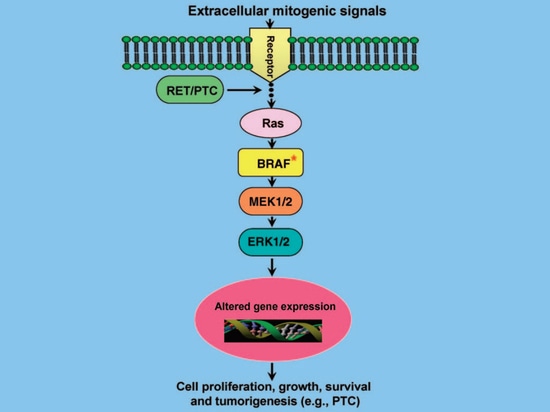
Le gène BRAF code pour une protéine kinase à sérine/thréonine et est un composant important de la voie de transduction du signal MAPK (voie RAS-RAF-MEK-ERK/MAPK kinase). Cette voie de signalisation joue un rôle important dans la prolifération, la différenciation, l'apoptose et d'autres fonctions cellulaires. Lorsqu'elle est activée de manière anormale, des tumeurs apparaissent. Dans les cellules normales, l'activation physiologique de cette voie est déclenchée par un grand nombre de facteurs de croissance, d'hormones et de cytokines par l'intermédiaire de leurs récepteurs sur la membrane cellulaire, puis active la kinase RAF par l'intermédiaire du GTP-RAS, activant ainsi la MEK en aval, puis la ERK en aval, la ERK activée phosphoryle les molécules de protéines régulatrices dans le noyau, et finalement modifie l'expression des gènes, changeant ainsi l'activité biologique de la cellule (Figure 3) [5]. Par conséquent, lorsque le gène BRAF est muté, il reste actif, activant continuellement la voie MAPK dans les cellules tumorales, et la croissance et le développement des cellules perdent le contrôle, ce qui conduit finalement à l'apparition d'une tumeur [5]. En outre, des études ont montré que les mutations de BRAF induisent une méthylation anormale des gènes suppresseurs de tumeurs liés à la CTP (TIMP3, DAPK, SLC5A8, RARβ2, etc.), ce qui accélère la progression de la tumeur [6]. Par exemple, le gène suppresseur de tumeur TIMP3 peut inhiber la croissance tumorale, l'angiogenèse, l'invasion et les métastases, et bloquer la liaison du facteur de croissance de l'endothélium vasculaire (VEGF) au récepteur du VEGF ; cependant, les mutations de BRAF entraînent la méthylation du gène TIMP3, ce qui conduit à la réduction au silence du gène. Il en résulte une perte de la fonction du gène, ce qui favorise la progression et le caractère invasif de la CTP [7].
Figure 3 Voie de signalisation MAPK
Mutation BRAF et récidive de la CTP
La plupart des études ont montré que les mutations BRAF augmentent le risque de récidive de la CTP, quels que soient les niveaux de risque associés aux facteurs clinicopathologiques, géographiques et ethniques. Xing et al. ont mené une étude multicentrique sur 219 patients atteints de CTP et ont analysé rétrospectivement la relation entre les mutations BRAF et la récidive tumorale dans la CTP primaire. Les résultats ont confirmé que les mutations BRAF sont étroitement liées à la récidive de la CTP [8]. Une étude de Kim et al a également montré que chez 203 patients atteints de CTP primaire, la mutation BRAF était étroitement liée à la récidive tumorale [9].
Figure 4 Comparaison des probabilités de non-récidive chez les patients atteints de CTP présentant des mutations du gène BRAF et chez ceux qui n'en présentent pas
Mutation BRAF et résistance à l'iode des CTP
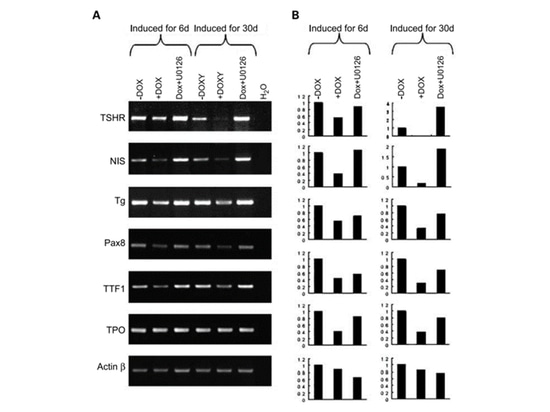
Après la thyroïdectomie, l'ablation à l'iode radioactif est le traitement principal de la CTP. Cette thérapie à l'iode radioactif utilise le cotransporteur sodium/iodure (NIS) des cellules thyroïdiennes pour absorber, concentrer et organiser l'iode. Ce processus nécessite la participation du récepteur de la thyrotropine (TSHR), de la thyroglobuline (Tg), de la peroxydase thyroïdienne (TPO) et des facteurs de transcription TTF-1 et Pax-8 [4]. Cependant, l'expression de ces gènes liés au métabolisme de l'iode est souvent endommagée ou perdue dans les CTP primaires ou récurrentes, et des études ont montré que ce phénomène était lié aux mutations BRAF [10]. Une étude [10] a induit l'expression de BRAF V600E et modifié l'activité de la voie MAPK, puis a détecté l'expression des gènes du métabolisme thyroïdien de l'iode. En induisant l'expression de BRAF V600E avec DOX (doxycycline) pendant 6 jours, l'expression des gènes TSHR, NIS, Tg et PAX8 liés au métabolisme de l'iode ont tous été régulés à la baisse ; et en ajoutant U0126 (inhibiteur MEK), l'expression des gènes régulés à la baisse a pu être restaurée. Après une induction à long terme de BRAF V600E (30 jours), ces gènes du métabolisme de l'iode thyroïdien réduits au silence pouvaient encore être rétablis par le traitement à l'U0126. Les résultats de la recherche montrent que le ciblage de la voie RAF-MEK-MAP est un bon moyen de restaurer la capacité de métabolisme de l'iode des PTC porteurs de mutations BRAF.
Figure 5 Étude sur l'expression des gènes du métabolisme de l'iode
En résumé, les mutations du gène BRAF sont étroitement liées au cancer papillaire de la thyroïde (CTP), peuvent être utilisées comme marqueur prédictif du pronostic du CTP et sont également étroitement liées au pronostic du patient. Le test du gène BRAF a une valeur clinique évidente dans le cas du CTP. Outre sa valeur pronostique, il permet également d'évaluer le risque de malignité des nodules thyroïdiens, de guider la sélection des plans chirurgicaux et d'orienter la thérapie ciblée. Cependant, il peut également y avoir des réarrangements RET/PTC, des mutations Ras, etc. dans la voie MAPK, et ils sont mutuellement exclusifs des mutations du gène BRAF [11].
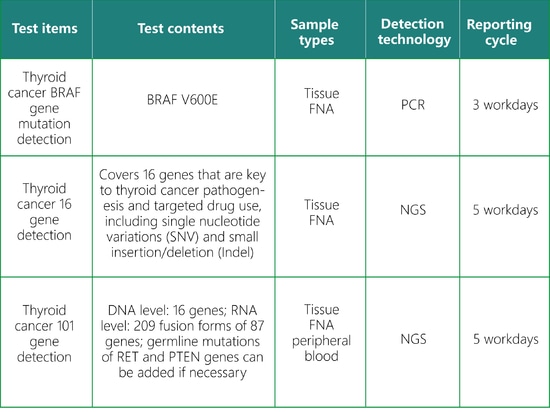
Test génétique du cancer de la thyroïde SpaceGen
La détection des mutations génétiques du cancer de la thyroïde par SpaceGen permet d'évaluer scientifiquement et précisément le risque de cancer de la thyroïde d'un individu et de formuler un plan de gestion personnalisé.
Références
[1] Dernières données du CIRC sur la charge mondiale de morbidité du cancer en 2020.
[2] Lignes directrices pour le diagnostic et le traitement du cancer de la thyroïde (édition 2022)
[3] Consensus d'experts du Guangdong sur les tests génétiques et l'application clinique du cancer de la thyroïde (édition 2020)
[4] Critical Reviews in Oncology/Hematology, 2014, 90(3).
[5] Endocrine Reviews 28(7):742-762.
[6] J Clin Endocrinol Metab 90:3028 -3035.
[7] Biochem Cell Biol 74:853- 862.
[8] J Clin Endocrinol Metab 90:6373- 6379.
[9] Clin Endocrinol (Oxf) 65:364 -368.
[10] Clin Cancer Res, 2007, 13(4) : 1341-1349.
[11] Lignes directrices du CSCO pour le diagnostic et le traitement du cancer différencié de la thyroïde (édition 2021)
Déclaration : Cet article est destiné à être partagé et ne représente pas la position de la plateforme. S'il y a des problèmes de droits d'auteur ou autres, veuillez nous contacter dès que possible et nous corrigerons la situation dans les plus brefs délais. Nous vous remercions de votre attention