Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Actualités du secteur
Les liens entre le cancer de la thyroïde et le gène RET
Les liens entre le cancer de la thyroïde et le gène RET
Dans le numéro précédent, nous avons abordé la relation entre le gène BRAF et le cancer de la thyroïde (voir "Le lien entre le cancer de la thyroïde et le gène BRAF"). Dans ce numéro, nous allons nous concentrer sur le gène RET et élucider les mystères qui entourent la relation entre le gène RET et le cancer de la thyroïde.
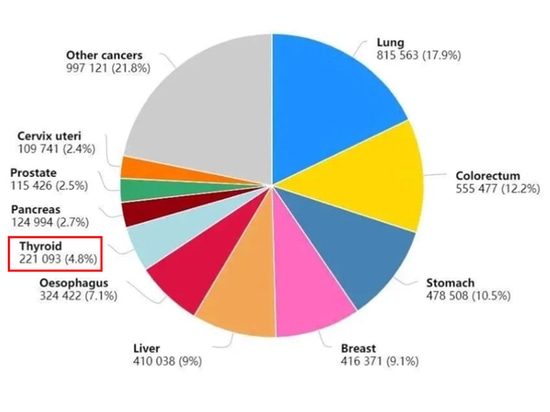
Figure 1 : Les dix premiers nouveaux cas de cancer en Chine en 2020
Ces dernières années, l'incidence du cancer de la thyroïde a connu une augmentation soutenue et rapide dans le monde entier, y compris en Chine. Le nombre annuel de nouveaux cas dans le monde est proche de 600 000, les patients chinois représentant plus d'un tiers de ce total (figure 1). Le ratio femmes/hommes est d'environ 3:1 [1].
Le gène RET, découvert en 1985, est un oncogène situé sur le bras long du chromosome 10 (10q11.2), s'étendant sur environ 60 kb et composé de 21 exons. Le gène RET code pour un récepteur tyrosine kinase qui régule la prolifération, la croissance, la différenciation, la migration et l'apoptose des cellules. Il joue également un rôle crucial dans le développement des organes et du système nerveux, et est associé à la production de spermatozoïdes chez l'homme [2].
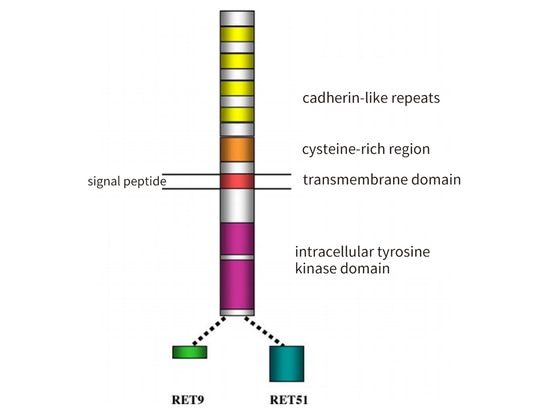
La protéine RET se compose de trois domaines : un domaine extracellulaire avec quatre séquences répétées de type protéine de liaison au calcium et une région riche en cystéine ; un domaine transmembranaire ; et un domaine tyrosine kinase intracellulaire. La protéine RET a trois sous-types : RET 51 (acide aminé long de 51), RET 43 (acide aminé moyen de 43) et RET 9 (acide aminé court de 9). Ils présentent des différences au niveau de la régulation temporelle et spatiale, de la localisation et du transport cellulaires, ainsi que des fonctions biologiques. Parmi eux, RET 51 et RET 9 sont les principaux sous-types, tous deux très conservés, mais RET 51 est plus efficace que RET 9 pour promouvoir la prolifération, la migration et l'ancrage des cellules [3] (Figure 2).
Figure 2 : Représentation schématique de la structure de la protéine RET
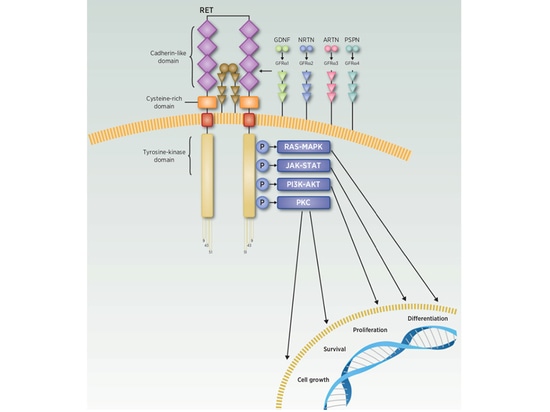
Comment le gène RET participe-t-il à la régulation du cycle de croissance cellulaire ? Et comment conduit-il à l'apparition de tumeurs ? La protéine RET est impliquée dans des voies de signalisation cellulaires telles que RAS-MAPK, PI3K-AKT, JAK-STAT et PKC, participant à des processus tels que la croissance, la prolifération, la différenciation et l'apoptose des cellules tout au long du cycle cellulaire. Cependant, seule la protéine RET activée peut activer les voies de signalisation en aval et jouer un rôle régulateur. Les recherches actuelles indiquent que l'activation de la protéine RET nécessite l'implication des ligands de la famille du facteur neurotrophique dérivé de la lignée cellulaire gliale (GDNF) et du récepteur-α de la famille du GDNF (GFRα). Il existe plusieurs types de GFL, dont le GDNF, mais aussi la neurturine (NRTN), l'artémine (ARTN) et la perséphine (PSPN). Lorsque les ligands GDNF, NRTN, ARTN et PSPN se lient aux récepteurs GFRα1, GFRα2, GFRα3 et GFRα4, respectivement, le complexe GFLs-GFRα se lie à RET, déclenchant son homodimérisation, la phosphorylation des résidus tyrosine et la transduction du signal intracellulaire qui s'ensuit, participant ainsi à la régulation du cycle de croissance cellulaire [4-5] (Figure 3).
Figure 3 Voie de transduction du signal RET
1.Cancer papillaire de la thyroïde (CTP) avec mutations du gène RET
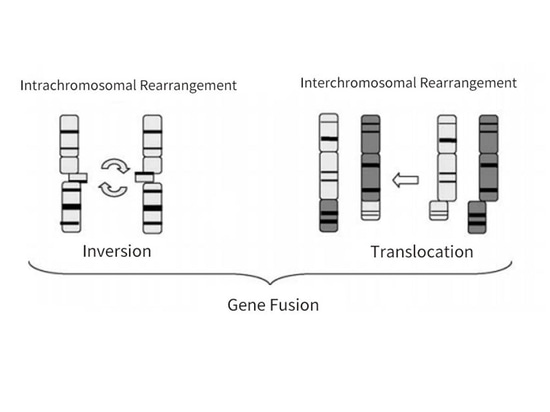
Le cancer de la thyroïde est la tumeur endocrinienne maligne la plus fréquente, provenant de l'épithélium folliculaire de la thyroïde ou des cellules épithéliales parafolliculaires (figure 4). Selon l'origine et la différenciation, le cancer de la thyroïde peut être divisé en cancer différencié de la thyroïde (CDT), cancer médullaire de la thyroïde (CMT), cancer peu différencié de la thyroïde (CPTD) et cancer anaplasique de la thyroïde (CAT). Parmi eux, le CPT est subdivisé en cancer papillaire de la thyroïde (CPT) et en cancer folliculaire de la thyroïde (CFT). Parmi tous les types histologiques, le CPT est le plus fréquent, représentant environ 90 % de tous les cancers de la thyroïde, tandis que le CTM est relativement rare, représentant environ 3 %. Des études ont montré que les mutations du gène RET se produisent le plus souvent dans le CTP et le CTM, le CTP présentant principalement un réarrangement du gène RET et le CTM des mutations du gène RET. Par rapport aux mutations BRAF les plus fréquentes dans les PTC, le réarrangement RET n'est pas très fréquent dans les PTC, représentant environ 10 à 20 %, et le réarrangement RET et les mutations BRAF s'excluent mutuellement. Les points de rupture du gène RET se produisent souvent dans l'intron 11, parfois dans les introns 7 et 10, ce qui entraîne une inversion ou une translocation de l'extrémité 3' du domaine kinase et de l'extrémité 5' d'autres gènes partenaires. Cette activation de la kinase RET produit des oncoprotéines chimériques, conduisant finalement au développement de tumeurs [6-8] (Figure 5).
Figure 5 : Réarrangement RET
Jusqu'à présent, plus de 35 gènes ont formé des gènes de fusion avec RET, parmi lesquels CCDC6-RET et NCOA4-RET sont les plus fréquents dans le carcinome thyroïdien papillaire (PTC), nommés respectivement RET/PTC1 et RET/PTC3, représentant 60 % et 30 % des types de réarrangement RET du PTC (Figure 6). Les radiations ionisantes sont un facteur commun de réarrangement de RET. Selon les rapports, l'incidence du réarrangement RET chez les patients atteints de PTC qui ont été exposés aux retombées radioactives de Tchernobyl ou touchés par les bombes atomiques au Japon est de 50 à 80 %. En outre, ce réarrangement est plus fréquent chez les enfants que chez les adultes. Les jeunes patients atteints d'un cancer de la thyroïde avec réarrangement RET présentent souvent une invasion extracapsulaire précoce, des métastases ganglionnaires et des métastases à distance, ce qui entraîne un stade plus élevé. Des études rétrospectives ont montré que le taux de diagnostic de malignité des nodules de catégorie III de Bethesda avec réarrangement RET/PTC est de 60 %, sans faux positifs, ce qui indique que le réarrangement RET/PTC est un marqueur hautement spécifique pour le diagnostic du CTP. Le consensus des experts chinois recommande un traitement chirurgical précoce et actif pour les CTP avec réarrangement RET [6-8].
Figure 6 Principaux types de réarrangements RET (cancer de la thyroïde)
2. Variants du gène RET dans le carcinome médullaire de la thyroïde (CMT)
Le carcinome médullaire de la thyroïde est une tumeur maligne causée par la sécrétion de calcitonine (Ctn) par les cellules C parafolliculaires. En fonction des caractéristiques génétiques de la maladie, le CTM est classé en deux catégories : héréditaire (20 %~25 %) et sporadique (75 %~80 %). Presque tous les cas de MTC héréditaire (HMTC) sont associés à des mutations germinales du gène RET, transmises selon un mode autosomique dominant. Cinquante pour cent des cas de MTC sporadiques présentent des mutations somatiques du gène RET. La MTC fait partie des néoplasies endocriniennes multiples de type 2 (NEM2) et peut être subdivisée en trois sous-types en fonction des caractéristiques cliniques : MEN2A, MEN2B et le carcinome médullaire familial de la thyroïde (FMTC). MEN2A est le sous-type le plus courant, représentant 60%~90% des familles MEN2 ; MEN2B représente 5%, avec un degré de malignité plus élevé ; FMTC est le sous-type le plus indolent de MEN2, se manifestant plus tard dans la vie [7, 9].
1. Mutations du gène RET et MEN2A
Quatre-vingt-quinze pour cent des patients atteints de MEN2A et présentant des mutations du gène RET présentent des points chauds dans six résidus de cystéine riches dans les régions extracellulaires de la protéine RET. Ces résidus sont principalement situés dans les codons 609, 611, 618 et 620 de l'exon 10, ainsi que dans les codons 630 et 634 de l'exon 11. Les résidus cystéine de ces sites sont fréquemment remplacés par d'autres acides aminés, ce qui réduit la formation de liaisons disulfure intramoléculaires. Cela favorise la formation d'homodimères de RET par le biais de liaisons disulfures intermoléculaires, ce qui entraîne une activation soutenue de RET en l'absence de ligands [7, 9, 10] (figure 7).
2. Mutations du gène RET et FMTC
Chez les patients atteints de FMTC, on trouve des mutations du gène RET non seulement dans les résidus cystéine extracellulaires, mais aussi dans d'autres résidus non cystéine, à la fois extracellulaires et intracellulaires. Les exemples incluent Gly533Cys (G533C) dans l'exon 8 du domaine extracellulaire, Glu768Asp (E768D), Leu790Phe (L790F), Tyr791Phe (Y791F), Val804Met/Leu (V804M/L), et Ser891Ala (S891A) dans les exons 13-15 du domaine kinase [7, 9, 10] (Figure 7).
3. Mutations du gène RET et MEN2B
Les patients atteints de MEN2B présentent des mutations liées au domaine kinase du gène RET. Quatre-vingt-quinze pour cent des patients atteints de MEN2B sont porteurs de la mutation M918T dans l'exon 16 du gène RET, tandis que moins de 5 % sont porteurs de la mutation A883F dans l'exon 15. Ces mutations peuvent modifier la conformation de la protéine, augmenter l'affinité de la liaison à l'ATP et réduire l'auto-inhibition [7, 9, 10] (Figure 7).
Figure 7 Types de mutation du gène RET de la famille MEN2
4.Mutations du gène RET et carcinome médullaire sporadique de la thyroïde (CMT)
Le carcinome thyroïdien médullaire sporadique implique principalement des mutations somatiques du gène RET. La mutation la plus fréquente est la M918T (environ 80 %), suivie par la deuxième mutation la plus fréquente, la mutation C634 (environ 15 %). D'autres mutations somatiques rares impliquent des sites tels que A883, C609, C630, entre autres. Des études indiquent que la mutation somatique M918T du gène RET est associée au caractère invasif du MTC. C'est pourquoi les lignes directrices recommandent de rechercher les mutations somatiques du gène RET chez les patients atteints de MTC avancé ou chez ceux qui envisagent un traitement sélectif par inhibiteurs de RET. Bien qu'il s'agisse d'une maladie sporadique, la recherche montre que 1 à 7 % des patients atteints de MTC sporadique sont en fait atteints de maladies héréditaires. C'est pourquoi les lignes directrices suggèrent que les patients atteints de MTC sporadique fassent l'objet d'un conseil génétique et d'un test de dépistage des mutations RET. Dans les MTC sporadiques, les mutations RET s'excluent mutuellement avec les mutations HRAS et KRAS [7, 9, 10].
5.Stratification du risque pour les sites de mutation du gène RET
Actuellement, plus de 100 types de mutations ponctuelles, de variations du nombre de copies, d'insertions ou de délétions dans le gène RET ont été associés à la MTC héréditaire. La malignité des tumeurs causées par les différents sites de mutation varie, et elles peuvent être classées dans le groupe à risque le plus élevé, le groupe à risque élevé et le groupe à risque modéré (figure 8). Différentes stratégies de prévention et de traitement seront employées en fonction des différents degrés de risque [7, 9, 10].
Figure 8 Sites de mutation du gène RET et risque de malignité du cancer médullaire héréditaire de la thyroïde
En résumé, la variation du gène RET est étroitement associée au cancer de la thyroïde, en particulier au cancer papillaire de la thyroïde (CPT) et au cancer médullaire de la thyroïde (CMT). Le réarrangement RET/PTC peut également être utilisé comme marqueur pour le diagnostic des nodules thyroïdiens bénins et malins. Il peut également contribuer au diagnostic du risque thyroïdien héréditaire et permettre une prévention opportune.
La détection des mutations génétiques du cancer de la thyroïde par SpaceGen permet d'évaluer scientifiquement et précisément le risque de cancer de la thyroïde d'un individu et de formuler un plan de gestion personnalisé.
Références
[1]CIRC 2020 : dernières données sur la charge mondiale de morbidité due au cancer.
[2]Cytokine & growth factor reviews,2005,16(4-5) : 441-467.
[3]Cytogenet Cell Genet 2001,95:169-76.
[4]Nature reviews Clinical oncology,2018,15(3):151-167.
[5]JMA J, 2020, 3(3) : 175-181.
[6] Lignes directrices pour le diagnostic et le traitement du cancer de la thyroïde (édition 2022)
[7]Consensus d'experts sur les tests génétiques RET et l'application clinique du cancer de la thyroïde (édition 2021)
[8] Consensus d'experts du Guangdong sur les tests génétiques et l'application clinique du cancer de la thyroïde (édition 2020)
[9] Consensus d'experts chinois sur le diagnostic et le traitement du cancer médullaire de la thyroïde (édition 2020)
[10] Lignes directrices du CSCO pour le diagnostic et le traitement du cancer médullaire de la thyroïde (édition 2022)