
Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Actualités du secteur
Exploration de la classification moléculaire du cancer de l'endomètre pour l'immunothérapie chez les patientes à un stade avancé.
Exploration de la classification moléculaire du cancer de l'endomètre pour l'immunothérapie chez les patientes à un stade avancé.
01
Contexte
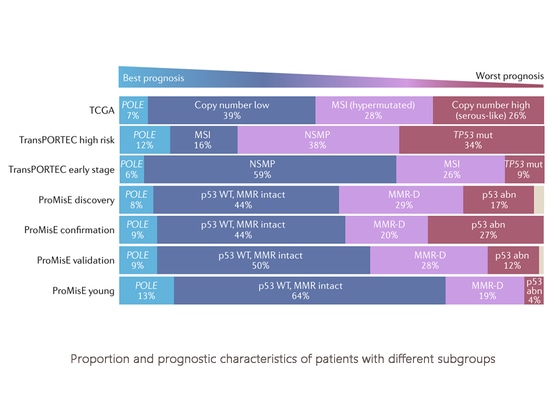
Au cours de la dernière décennie, le développement d'un système de classification moléculaire a constitué une avancée significative dans le diagnostic et le traitement du cancer de l'endomètre. Les caractéristiques moléculaires contribuent à la compréhension du risque de récidive et des résultats en termes de survie. L'utilisation de méthodes de détection moléculaire permet de classer le cancer de l'endomètre en quatre catégories moléculaires distinctes : Type POLE ultramuté (POLEmut), instabilité des microsatellites ou défaut de réparation des mésappariements (MSI-H ou MMRd), profil moléculaire non spécifique (NSMP) et type anormal de p53 (p53abn). Chaque catégorie correspond à un pronostic différent, POLEmut ayant généralement le meilleur pronostic, p53abn le plus mauvais et les deux autres catégories ayant un pronostic intermédiaire. La classification moléculaire a été incorporée dans les directives cliniques (NCCN, CSCO, etc.) et dans la dernière stadification de la FIGO. Les méthodes de détection de la classification moléculaire comprennent la NGS (typage complet), l'immunohistochimie (protéine MMR, protéine p53), le séquençage Sanger (mutations POLE hotspot) et l'analyse des fragments (MSI). Quelle que soit la méthode utilisée pour la détection, chacune présente des avantages uniques.
Processus de détection de la classification moléculaire du cancer de l'endomètre[1]
Proportion et caractéristiques pronostiques des patientes appartenant à différents sous-groupes
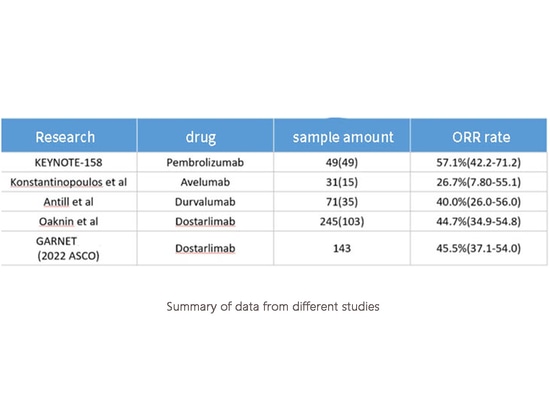
La RMM et la MSI sont des biomarqueurs permettant de prédire l'efficacité de l'immunothérapie. C'est pourquoi les lignes directrices du NCCN recommandent l'utilisation d'inhibiteurs de points de contrôle immunitaires en monothérapie pour les cancers de l'endomètre récurrents présentant un déficit de réparation des mésappariements (MMRd). Cependant, l'efficacité de l'immunothérapie en monothérapie pour le cancer de l'endomètre MMRd n'est pas "remarquable", avec un taux de réponse global (ORR) moyen de seulement 45 %.
Résumé des données de différentes études
02
Cancer de l'endomètre avancé et récidivant traitement de première ligne nouvelle recherche
Cette année à l'ESMO, les études GY018 et RUBY ont exploré de nouvelles approches thérapeutiques pour le traitement de première intention du cancer de l'endomètre avancé ou récurrent. Les deux études ont porté sur des populations de patients légèrement différentes. L'étude GY018 portait sur des patientes atteintes d'un cancer de l'endomètre mesurable de stade III/IVA ou mesurable/non mesurable de stade IVB ou récurrent. En revanche, l'étude RUBY a inclus des patientes présentant des lésions mesurables aux stades IIIA-IIIC1 lors du traitement initial, aucune lésion évaluable lors du traitement initial pour un sarcome cancéreux, un carcinome à cellules claires ou une histologie mixte, et des stades IIC2-IV sans lésions évaluables ou un cancer de l'endomètre récurrent.
Dans l'étude GY018, à la date limite d'analyse des données, la durée médiane de suivi dans la cohorte dMMR (mismatch repair-deficient) était de 12 mois. Le taux de survie sans progression (SSP) était de 74 % dans le groupe pembrolizumab en monothérapie, contre 38 % dans le groupe placebo. La médiane de la SSP n'a pas été atteinte dans le groupe pembrolizumab contre 7,6 mois dans le groupe placebo. Le pembrolizumab en monothérapie a réduit le risque de progression de la maladie et de décès de 70 % (HR 0,30 ; IC 95 %, 0,19-0,48 ; P<0,001).
Dans la cohorte pMMR (mismatch repair-proficient) avec une durée médiane de suivi de 7,9 mois, la SSP médiane était de 13,1 mois contre 8,7 mois pour les groupes pembrolizumab en monothérapie et placebo, respectivement. La monothérapie par pembrolizumab a réduit le risque de progression de la maladie et de décès de 46 % (HR 0,54 ; IC à 95 %, 0,41-0,71 ; P<0,001).
Résultats de l'étude GY018[2]
Du point de vue de la recherche RUBY, à partir de l'analyse des données, dans la file d'attente dMMR/MSI-H, le taux de SSP du groupe dostarlimab est de 61,4 %, tandis que celui du groupe placebo est de 15,7 %. Le dostarlimab réduit le risque de progression de la maladie et de décès des patients de 72 % (HR 0,28 ; 95% CI, 0,16-0,50 ; P<0,001) ; les taux de SG sont de 83,3 % contre 58,7 %, et le dostarlimab réduit le risque de décès des patients de 70 % (HR 0,30 ; 95% CI, 0,33-0,70).
Dans la file d'attente pMMR, les taux médians de SSP pour les deux groupes sont de 28,4 % contre 18,8 %, et le dostarlimab réduit le risque de progression de la maladie et de décès des patients de 24 % (HR 0,76 ; IC à 95 %, 0,59-0,98) ; les taux de SG sont de 67,7 % contre 55,1 %, et le dostarlimab réduit le risque de décès des patients de 27 % (HR 0,73 ; IC à 95 %, 0,52-1,02).
Résultats de l'étude RUBY[3]
Résultats de l'étude RUBY[3]
Cependant, des incertitudes subsistent quant à savoir si les patients atteints d'autres sous-types peuvent également bénéficier de l'immunothérapie. C'est pourquoi l'étude RUBY a mené une analyse plus approfondie sur les patients présentant d'autres sous-types. Dans la première partie de l'étude RUBY, une classification moléculaire a été effectuée sur les résultats du séquençage de l'exome entier (WES) de tous les patients inscrits. L'analyse a porté sur 400 des 494 patients (400/494). Les résultats ont montré que dans le sous-groupe des mutations POLE, les patients avaient un bon pronostic, sans récidive ni décès, ce qui suggère que l'observation peut être envisagée. Dans le sous-groupe dMMR/MSI-H, l'immunothérapie a significativement amélioré la survie sans progression (PFS) et la survie globale (OS), réduisant le risque de récidive et de décès d'environ 70%. De même, dans le sous-groupe de patients présentant une mutation de la protéine P53, l'immunothérapie a également amélioré de manière significative la SSP et la SG. Dans le sous-groupe NSMP (profil moléculaire non spécifique), l'impact de l'immunothérapie sur la SSP et la SG n'était pas significatif. Par conséquent, sur la base des résultats cliniques de l'étude RUBY, les patients atteints de dMMR/MSI-H à un stade avancé, récurrents et métastatiques et de sous-types de mutation P53 peuvent grandement bénéficier de l'immunothérapie, tandis que les bénéfices pour les autres sous-types ne sont pas significatifs.
SSP selon la classification moléculaire[4-5]
SG selon la classification moléculaire[4-5]
03
Résumé
L'immunothérapie joue un rôle de plus en plus important dans le cancer de l'endomètre, offrant de nombreuses opportunités critiques pour le traitement des patientes atteintes d'un cancer de l'endomètre avancé. Pour les patientes atteintes d'un cancer de l'endomètre MSI-H/dMMR, l'immunothérapie améliore la précision du traitement du cancer de l'endomètre. Pour les patientes atteintes d'un cancer de l'endomètre MSS/pMMR, l'immunothérapie, en association avec d'autres traitements, garantit des possibilités de traitement pour un plus grand nombre de patientes et ouvre de nouvelles voies de traitement. À l'avenir, les biomarqueurs émergents tels que le TMB pourraient ouvrir de nouvelles perspectives pour l'immunothérapie du cancer de l'endomètre. Avec l'exploration généralisée de l'immunothérapie, de la thérapie ciblée et d'autres approches dans les tumeurs gynécologiques, la tendance à la précision et au traitement individualisé redessine le paysage du diagnostic et du traitement des tumeurs gynécologiques. On s'attend à ce que, dans un avenir proche, le diagnostic et le traitement gynécologiques continuent à s'optimiser et à s'améliorer, ce qui permettra de réaliser de nouvelles percées dans le diagnostic et le traitement du cancer de l'endomètre.
Références
[1]Lignes directrices du NCCN pour le diagnostic et le traitement des tumeurs utérines 2024.v1
[2]N Engl J Med. 2023 Jun 8;388(23):2159-2170.
[3]N Engl J Med. 2023 Jun 8;388(23):2145-2158.
[4]https://clinicaltrials.gov/ct2/show/NCT03981796.
[5]Mirza MR, et al. 2023 ESMO 740MO.
Déclaration : Cet article est destiné à être partagé. S'il existe des problèmes de droits d'auteur, veuillez nous contacter dès que possible et nous les corrigerons dans les plus brefs délais. Nous vous remercions de votre attention
![Processus de détection de la classification moléculaire du cancer de l'endomètre[1]](https://img.medicalexpo.fr/images_me/projects/images-om/49090-19244879.jpg)
![Résultat de l'étude GY018[2]](https://img.medicalexpo.fr/images_me/projects/images-om/49090-19244882.jpg)
![Résultat de l'étude RUBY[3]](https://img.medicalexpo.fr/images_me/projects/images-om/49090-19244884.jpg)
![Résultat de l'étude RUBY[3]](https://img.medicalexpo.fr/images_me/projects/images-om/49090-19244885.jpg)
![SSP selon la classification moléculaire[4-5]](https://img.medicalexpo.fr/images_me/projects/images-om/49090-19244886.jpg)
![OS selon la classification moléculaire[4-5]](https://img.medicalexpo.fr/images_me/projects/images-om/49090-19244889.jpg)




