Voir la traduction automatique
Ceci est une traduction automatique. Pour voir le texte original en anglais cliquez ici
#Actualités du secteur
Cell rep:La prise de sélénium peut prévenir efficacement la leucémie myéloïde aiguë
Cell rep:La prise de sélénium peut prévenir efficacement la leucémie myéloïde aiguë
Contexte
La leucémie myéloïde aiguë (LMA) est une tumeur maligne caractérisée par une prolifération anormale de cellules progénitrices hématopoïétiques et de cellules souches infiltrant la moelle osseuse, le sang et d'autres tissus. L'hétérogénéité cytogénétique et moléculaire contribue à la nature réfractaire et à la rechute de la LAM. L'un des principaux obstacles au traitement est la maladie résiduelle minimale (MRD), caractérisée par la présence de cellules initiatrices de leucémie (LIC), qui sont cruciales pour la rechute de la maladie dans une certaine mesure. Ces cellules présentent des similitudes avec les cellules souches hématopoïétiques normales en termes d'auto-renouvellement, de prolifération et de différenciation. Par conséquent, comme les composants des cellules souches cancéreuses sont mieux définis, les thérapies alternatives ciblant les PFR ouvrent de nouvelles voies pour traiter la LAM et d'autres tumeurs malignes.
Le GPR44 est exprimé dans divers types de cellules, mais on le trouve principalement dans les cellules effectrices Th2. La littérature existante sur le GPR44 se concentre principalement sur son rôle dans les maladies auto-immunes et l'immunité de type 2, avec un manque notable de recherche sur son rôle dans les hémopathies malignes.
Dans cette étude, les auteurs ont découvert que l'activation du GPR44 pouvait avoir des effets antileucémiques endogènes. Plus précisément, l'ajout de sélénium à des LIC provenant d'un modèle de LMA chez la souris et à des cellules de LMA dérivées de patients a entraîné la production de prostaglandines cyclopenténones (CyPG). Les CyPGs, après activation du GPR44, inhibent les voies de signalisation MAPK et PI3K/AKT/mTOR médiées par le KRAS, favorisant ainsi l'apoptose des cellules de la LMA. Ces résultats soulignent le rôle thérapeutique important du GPR44 dans la leucémie et fournissent une base mécaniste pour les propriétés chimiopréventives du sélénium et des CyPGs dans la LMA.
Résultats de la recherche
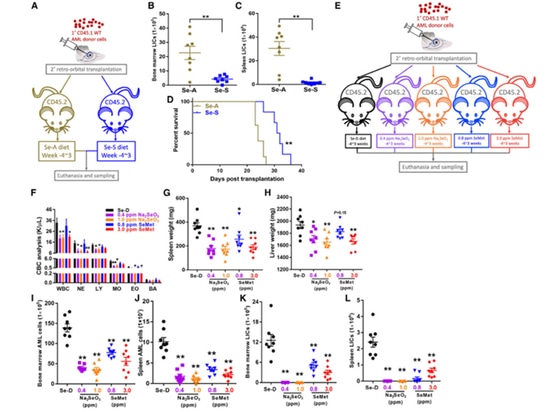
1.Une supplémentation en sélénium peut améliorer le pronostic de la leucémie myéloïde aiguë (LMA).
L'auteur a d'abord transplanté des cellules AML CD45.1 WT dans des souris receveuses CD45.2 qui avaient été nourries avec du Se-A ou du Se-S pendant 4 semaines, créant ainsi des souris AML secondaires. Après 3 semaines, les souris ont été sacrifiées et des échantillons de sang, de moelle osseuse et de rate ont été prélevés. On a observé que le Se-S réduisait de manière significative le nombre de cellules initiatrices de leucémie (LIC) dans la moelle osseuse et la rate, prolongeant ainsi la survie des souris LMA. Par la suite, les effets de différentes formes de sélénium alimentaire (y compris Na2SeO3 et SeMet) sur les souris LAM ont été comparés, révélant que le sélénium alimentaire pouvait réduire les niveaux de globules blancs. Il atténue également l'hypertrophie de la rate et du foie. Les résultats de la recherche de l'auteur confirment que la supplémentation en sélénium dans le régime alimentaire peut inhiber efficacement la LAM, et que le Na2SeO3 présente un avantage préventif par rapport au SeMet dans la LAM.
Figure 1. La supplémentation en sélénium améliore l'issue de la LAM
2.La supplémentation en sélénium induit la production de CyPG endogènes dans la LAM.
Les auteurs ont ensuite mesuré les niveaux de 15d-PGJ2 (prostaglandine J2) dans le sérum de souris atteintes de LAM et évalué l'expression de la cyclooxygénase-1 (COX-1) et de la PGD synthase hématopoïétique (H-PGDS). Les résultats ont montré qu'un régime enrichi en sélénium augmentait de manière significative l'expression des protéines pertinentes COX-1 et H-PGDS, favorisant une augmentation des niveaux de PGJ2.
Pour étudier plus avant le rôle potentiel de la H-PGDS, les auteurs ont traité des souris Se-S AML avec l'inhibiteur de la H-PGDS HQL79 afin de bloquer la production de CyPGs endogènes. Les résultats ont montré que le traitement par HQL79 augmentait la charge tumorale et la teneur en LIC dans la moelle osseuse et la rate des souris Se-S. En conclusion, ces résultats suggèrent que la supplémentation en sélénium atténue la LAM en augmentant les CyPGs endogènes par le biais d'une expression accrue de H-PGDS.
Figure 2. La supplémentation en sélénium induit la production endogène de CyPGs dans la LAM
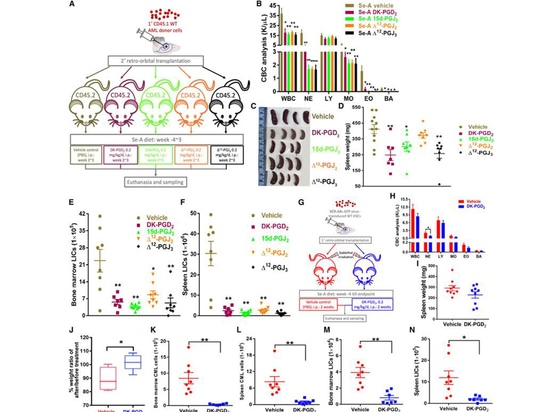
3.L'activation du GPR44 peut réduire la gravité de la leucémie
Les auteurs ont ensuite testé si différentes formes de CyPG exogènes pouvaient traiter la LMA chez les souris Se-A. Les résultats ont montré que le traitement avec des CyPGs (DK-PGD2, 15d-PGJ2, Δ12-PGJ2, et D12-PGJ3) réduisait la CBC chez les souris et ralentissait la splénomégalie, à l'exception de DK-PGD2, tous les autres composés induisaient la mort des cellules de leucémie myéloïde aiguë humaine (MOLM13) de manière dépendante de la dose et du temps. En outre, dans les cellules MOLM13, l'expression du GPR44 a été détectée à la fois au niveau de la transcription et de la protéine, avec une augmentation significative de sa forme intracellulaire. Cela souligne l'importance des CyPG dans la localisation du GPR44 à la membrane cellulaire dans la LAM.
Les auteurs ont ensuite validé la pertinence clinique en traitant des cellules de LAM dérivées de patients avec DK-PGD2 ou 15d-PGJ2. Sur 12 échantillons de patients atteints de LMA, 9 ont répondu au DK-PGD2, montrant une apoptose cellulaire accrue. L'examen a révélé que les patients sensibles au traitement par DK-PGD2 présentaient une expression plus élevée du GPR44, plus de quatre fois supérieure à celle des échantillons réfractaires, ce qui souligne le rôle crucial du GPR44 dans la LMA. Ces résultats indiquent que l'augmentation des CyPG endogènes ou l'utilisation de doses pharmacologiques de CyPG exogènes permet de traiter efficacement la leucémie myéloïde.
Figure 3. L'activation du GPR44 diminue la sévérité de la leucémie
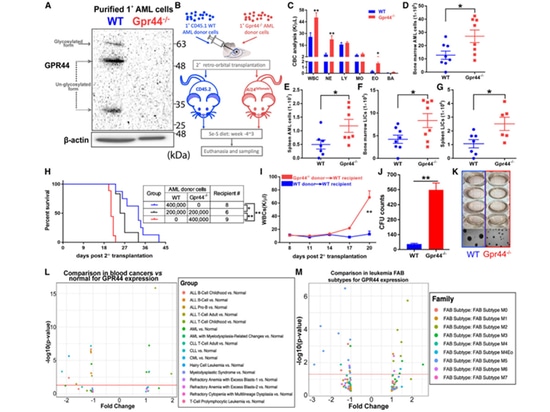
4.L'absence de GPR44 dans les cellules de la LAM entraîne des maladies agressives. Des études antérieures ont indiqué que le GPR44 joue un rôle crucial dans l'apoptose des cellules de la LAM induite par le CyPG. Les auteurs ont donc validé les effets de la déficience en GPR44 sur les cellules de la LAM. Par rapport au contrôle, la transplantation de cellules de LAM GPR44 - / - avec un régime Se-S a conduit à une augmentation des globules blancs récepteurs WT et à une augmentation de la taille de la rate. Chez les souris transplantées avec des cellules GPR44 - / - LAM, le nombre total de cellules Lin - LAM et de LIC dans la moelle osseuse et la rate a été multiplié par plus de deux par rapport aux souris transplantées avec des cellules WT LAM. La perte du GPR44 a décuplé la capacité des cellules de la LAM à former des colonies, ce qui suggère qu'une forte expression du GPR44 pourrait être une cible pour la thérapie CyPG plutôt qu'un facteur de pronostic.
Figure 4. L'absence de GPR44 dans les cellules de la LAM entraîne une maladie agressive
5. L'activité de PPARγ influence la progression de la LAM Gpr44-/-
Étant donné que PPARγ et GPR44 partagent les mêmes ligands, les auteurs ont étudié la diaphonie potentielle entre PPARγ et GPR44. Des souris Se-S avec des cellules de LAM Gpr44 - / - ont été traitées avec l'antagoniste sélectif de PPARγ GW9662, ce qui a entraîné une augmentation significative de la numération globulaire par rapport aux souris traitées avec l'agent de contrôle, accompagnée d'une splénomégalie. En revanche, les souris Se-S atteintes de LAM Gpr44 - / - et traitées à la rosiglitazone (un agoniste PPARγ) ont présenté une diminution des taux de globules blancs et une splénomégalie. Dans l'ensemble, ces données suggèrent que les cellules de LAM dépourvues d'expression du GPR44 peuvent encore être partiellement affectées par le Se ou des CyPG ciblés par le biais de la signalisation PPARγ, conduisant à la mort cellulaire probablement par le biais de l'activation de P53. Cependant, l'expression du GPR44 activé entraîne une réponse plus forte aux LICs libres de la LAM.
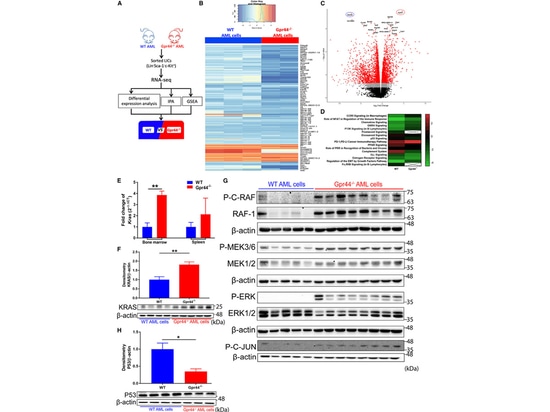
6.L'absence d'activation du GPR44 affecte la signalisation KRAS-MAPK dans les cellules de la LAM
Par la suite, les auteurs ont effectué une analyse de séquençage de l'ARN sur des LICs AML WT et GPR44 - / - et ont constaté des changements significatifs dans le programme transcriptionnel en raison de la déficience en GPR44. En outre, l'expression de l'ARNm et de la protéine KRAS a augmenté de manière significative dans les cellules LMA GPR44 - / -. Une phosphorylation accrue des composants MAPK (RAF, MEK et ERK) a été observée dans les cellules de LAM GPR44 - / -, accompagnée d'une expression accrue de RAF-1. L'effet en aval de la signalisation MAPK, l'augmentation de la phosphorylation de C-JUN, a confirmé l'activation de la signalisation MAPK dans les cellules GPR44 - / - AML, ce qui est cohérent avec le rôle de la signalisation KRAS-MAPK dans le développement de la leucémie. Ceci fournit une explication supplémentaire au caractère invasif accru des cellules GPR44 - / - de la LAM.
Figure 5. L'absence de GPR44 active la signalisation KRAS-MAPK dans les cellules de la LAM
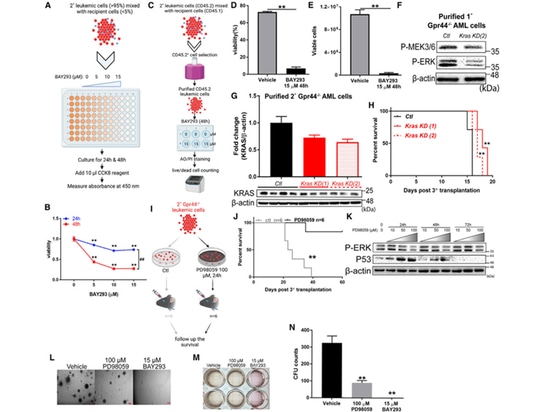
7.L'inhibition de la signalisation KRAS/MAPK inverse l'impact du knock-out du GPR44 sur la LAM.
L'auteur a utilisé des méthodes telles que l'inhibiteur de KRAS BAY293, des lentivirus exprimant dCas9KRAB33 et des ARNg spécifiques ciblant le promoteur de KRAS chez la souris pour la validation. Les résultats ont démontré une diminution significative de la viabilité des cellules de LAM GPR44 - / -, ainsi qu'une réduction notable de l'expression des gènes anti-apoptotiques et des gènes liés au cycle cellulaire. Le taux de survie des souris receveuses a également augmenté de manière significative.
Par la suite, l'auteur a traité les cellules GPR44 - / - AML avec l'inhibiteur sélectif de MEK PD98059 in vitro, ce qui a conduit à une augmentation du taux de survie chez les souris transplantées. Les cellules de LAM GPR44 - / - traitées au PD98059 présentaient une diminution de l'expression de P-ERK, une augmentation de l'expression de P53 et un affaiblissement de l'expression des gènes anti-apoptotiques, des gènes liés au cycle cellulaire et des gènes de quiescence des cellules souches. L'inhibition de KRAS ou de MEK a altéré la capacité de formation de colonies des cellules GPR44 - / - AML.
En résumé, ces données démontrent un certain lien entre le GPR44 et la régulation de la signalisation KRAS/MAPK. Cela pourrait servir de cible alternative pour inverser la détérioration de la LMA en l'absence de GPR44"
Figure 6. L'inhibition de la signalisation KRAS/MAPK inverse l'effet associé au GPR44 KO dans la LAM
8.La perte du GPR44 aggrave la LAM en activant la voie PI3K/AKT/mTOR.
Le gène KRAS est impliqué dans la voie de signalisation PI3K/AKT/mTOR. Les auteurs ont donc procédé à une évaluation des cellules de LAM WT (type sauvage) et GPR44 - / - (GPR44 knockout). Dans les cellules de LAM GPR44 - / -, l'expression et les niveaux de phosphorylation de PI3K et AKT étaient significativement augmentés. En outre, l'expression de la PKA et de la PKC a augmenté. La forte diminution de la PTEN et de la P-PTEN suggère que la perte du GPR44 peut avoir un impact négatif sur le rôle suppresseur de tumeur de la PTEN dans la LAM. L'utilisation d'inhibiteurs de PI3K (LY294002 et Wortmannin) a entraîné une diminution de la viabilité et une inhibition de la capacité de formation de colonies dans les cellules GPR44 - / - de la LAM, ce qui indique que PI3K est fortement exprimé et activé dans ces cellules.
Résumé de l'article
Dans cette étude, la supplémentation en sélénium alimentaire avec le GPR44 dans un modèle de souris leucémique humaine, dans des lignées cellulaires humaines de LAM et dans des échantillons de patients a entraîné l'apoptose des LIC (cellules initiatrices de leucémie) de la LAM déclenchée par des CyPG endogènes produites par la voie COX-H-PGDS ou par l'activation de CyPG exogènes. Chez les souris atteintes de LAM, l'absence de GPR44 a exacerbé la maladie par l'augmentation des voies de signalisation MAPK et PI3K/AKT/mTOR médiées par KRAS et liées à RTK. Les CyPG n'ont pas affecté les cellules souches hématopoïétiques normales dans la moelle osseuse des souris LMA ou LMC, ce qui en fait une option thérapeutique sûre qui garantit une récupération efficace de la fonction hématopoïétique normale pendant la leucémie.